
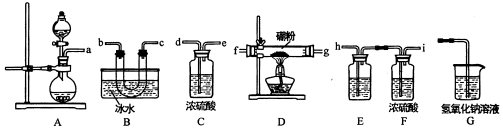
分析 在加热条件下,二氧化锰和浓盐酸在A中发生氧化还原反应生成Cl2,但浓盐酸具有挥发性,水被加热也能蒸发,升高温度加快浓盐酸挥发、加快水蒸发,所以生成的Cl2中含有HCl、H2O,为了得到较纯净的Cl2,饱和食盐水能吸收HCl,浓硫酸能干燥气体,故连接EF装置,在D中制得BCl3,然后用B得到BCl3固体,为防止G中的水蒸气进入B装置使生成的BCl3水解,需在B和G中间添加装置C装浓硫酸进行干燥,G吸收未反应的Cl2,据此分析作答.
解答 解:(1)A装置可用高锰酸钾固体与浓盐酸反应制氯气,反应的化学方程式为:2KMnO4+16HCl=2MnCl2+2KCl+8H2O+5Cl2↑;
故答案为:2KMnO4+16HCl=2MnCl2+2KCl+8H2O+5Cl2↑;
(2)A中生成Cl2,但生成的Cl2中含有HCl、H2O,为了得到较纯净的Cl2,饱和食盐水能吸收HCl,浓硫酸能干燥气体,故a连接hi,在D中制得BCl3,故再连接fg(或gf),然后用B得到BCl3固体,连接bc(或cb),为防止G中的水蒸气进入B装置使生成的BCl3水解,需在B和G中间添加装置C装浓硫酸进行干燥,G吸收未反应的Cl2,则再连接dej;
故答案为:a-hi-fg(或gf)-bc(或cb)-de-j;
(3)E中试剂为饱和食盐水,为吸收氯气中的HCl气体,若无此装置,氯化氢气体进入D装置,硼粉与氯化氢气体反应生成的产物中有氢气,加热氢气与氯气的混合气体,易发生爆炸;
故答案为:饱和食盐水;硼粉与氯化氢气体反应生成的产物中有氢气,加热氢气与氯气的混合气体,易发生爆炸;
(4)硼粉易被空气中的氧气氧化,故D装置中发生反应前先通入一段时间的氯气,其目的是排尽装置中的空气,避免氧气与硼粉发生反应生成B2O3,D装置中发生反应的化学方程式为:2B+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2BCl3;
故答案为:排尽装置中的空气,避免氧气与硼粉发生反应生成B2O3;2B+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2BCl3;
(5)因硼与铝的性质相似,硼酸的化学式为H3BO3,类似铝酸(H3AlO3).因三氯化硼遇水能反应,反应的化学方程式为:BCl3+3H2O=H3BO3+3HCl↑;
故答案为:BCl3+3H2O=H3BO3+3HCl↑;
(6)由于B的性质与Al相似,既能与强酸反应,也能与强碱反应放出氢气,所以取少量样品于试管中,滴加浓NaOH溶液,若有气泡产生,则样品中含有硼粉,若无气泡产生,则样品中无硼粉;
故答案为:取少量样品于试管中,滴加浓NaOH溶液,若有气泡产生,则样品中含有硼粉,若无气泡产生,则样品中无硼粉.
点评 本实验属于物质制备与检验综合设计实验,为高频考点,侧重于学生的分析能力和实验能力的考查,题目涉及制备气体、净化气体、干燥气体和尾气处理,目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 向海水中加入净水剂明矾可以使海水淡化 | |
| B. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| C. | 海水淡化的方法主要有电渗析法、蒸馏法、离子交换法等 | |
| D. | 海洋植物具有富集碘的能力,因此从海产品中提取碘是工业上获取碘的重要途径,工业从海带中提取碘经历的步骤有:浸泡-过滤-氧化-萃取-粗碘提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
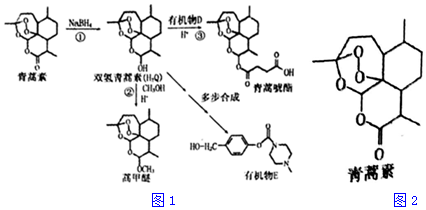
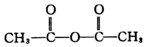 +H-OH→
+H-OH→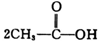
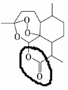 ;根据酯的性质判断青蒿素可能具有的某种化学性质和反应条件为可在酸性或碱性条件下发生水解反应.屠呦呦教授率领的研究团队先后经历了用水、乙醇、乙醚提取青蒿素的探究过程,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素;研究发现这是因为青蒿素分子中的某个基团在提取过程中对热不稳定,试写出该基团的结构式-O-O-.
;根据酯的性质判断青蒿素可能具有的某种化学性质和反应条件为可在酸性或碱性条件下发生水解反应.屠呦呦教授率领的研究团队先后经历了用水、乙醇、乙醚提取青蒿素的探究过程,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素;研究发现这是因为青蒿素分子中的某个基团在提取过程中对热不稳定,试写出该基团的结构式-O-O-.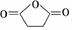 .
.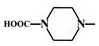 外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式
外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式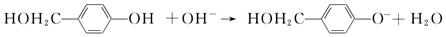 ,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.
,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
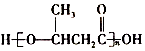 )的流程如图:
)的流程如图: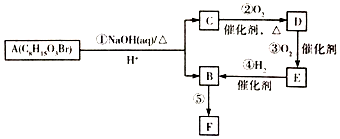
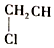 =
=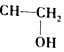
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、M的离子半径为M<W | |
| B. | YZ2为直线形的共价化合物,W2Z2既含有离子键又含有共价键 | |
| C. | Z与X形成的化合物的熔沸点偏高是因其分子内存在氢键 | |
| D. | Z与M形成的化合物可作为耐高温材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验及试剂 | 编号 | 无色NaClO3溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
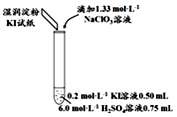 | 1 | 0.05mL | 浅黄色 | 无色 |
| 2 | 0.20mL | 深黄色 | 无色 | |
| 3 | 0.25mL | 浅黄色 | 蓝色 | |
| 4 | 0.30mL | 无色 | 蓝色 |
| 编号 | 6.0mol•L-1 H2SO4 溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 5 | 0.25mL | 浅黄色 | 无色 |
| 6 | 0.85mL | 无色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.80g Na2O2与5.85g NaCl所含阴离子数相等 | |
| B. | 常温常压,16g氧气与臭氧的混合物,氧原子为NA | |
| C. | 一定条件下,1.4g N2和0.2mol H2混合充分反应,转移的电子数为0.3NA | |
| D. | 常温下,2L pH=12的Na2CO3溶液中含有OH-数目为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸与铜会剧烈反应,浓硝酸起到了氧化剂和酸性的作用 | |
| B. | Cl2溶于水后可以漂白有色布条,且久置后布条可以恢复原色 | |
| C. | 铁遇冷的浓硫酸钝化,说明铁和冷的浓硫酸不会发生反应 | |
| D. | NaOH可与玻璃反应,所以可以用浓NaOH溶液在玻璃上作画 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com