
在体积为VL的密闭容器中,通入a mol NO和b molO2,反应后容器内氮原子数和氧原子数之比为 ( )
A.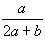 B.
B.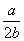 C.
C.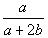 D.无法确定
D.无法确定
科目:高中化学 来源: 题型:
据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量更大,而且没有铅污染。其电池反应为:2Zn+O2=2ZnO,原料为锌粒、电解液和空气,则下列叙述正确的是
A.锌为正极,空气进入负极反应 B.负极反应为:Zn-2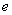 -=Zn2+
-=Zn2+
C.正极发生氧化反应 D.正极反应为: Zn-2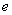 -=Zn2+
-=Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列事实,判断离子的氧化性顺序为①A+B2+===A2++B②D+2H2O===D(OH)2+H2↑ ③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E,B-2e-=B2+ ( )
A.D2+>A2+>B2+>E2+ B.D2+> E2+ >B2+> A2+
C.E2+>B2+>A2+>D2+ D.A2+>B2+>D2+>E2+
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)===Si(s)+4HCl(g)
ΔH=+Q kJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol·L-1·min-1
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液中恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在2 L的密闭容器内,800℃时反应2NO(g)+O2(g)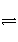
 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1) 写出该反应的平衡常数表达式:K=_____________________________________。
已知:K300℃>K350℃,则该反应是______热反应。
(2)下图表示NO2的变化的曲线是__________。用O2表示从0~2 s内该反应的平均速率v=________________________________________________________________________。
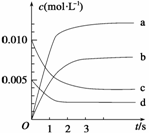
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
关于元素周期表的下列叙述,错误的是 ( )
A.元素周期表揭示了化学元素的内在联系,是化学发展史上的重要里程碑之一
B.在周期表中,把电子层数相同的元素排成一横行,称为一周期
C.元素周期表中,总共有18个纵行,18个族
D.第IA族的元素又称为碱金属(除了H),第VIIA族的元素又称为卤素
查看答案和解析>>
科目:高中化学 来源: 题型:
海水淡化是指除去海水中的盐分以获得淡水的工艺过程,其方法较多,如反渗透法、电渗析法、离子交换法等,下列方法中也是用来进行海水淡化的是 ( )
A.过滤法 B. 萃取法 C.分液法 D.蒸馏法
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数的值。下列判断正确的是
A.28g N2含有的氮原子数目为NA
B.常温常压下,22.4L Cl2含有的分子数目为NA
C.1molNa变为Na+时失去的电子数目为NA
D.1L 1mol·L—1K2CO3溶液中含有的钾离子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的分类合理的是
A.氧化物:CuO、NO、SO2、H2O
B.碱:NaOH、KOH、Ba(OH)2、Na2CO3
C.碱性氧化物:Na2O、CaO、Al2O3、Na2O2
D.电解质:KNO3 、Cl2、HCl 、BaSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com