
【题目】三氧化钼(![]() )是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为
)是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为![]() )通过一定条件来制备。回答下列相关问题:
)通过一定条件来制备。回答下列相关问题:
⑴已知:①![]()
![]()
②![]()
![]()
③![]()
![]()
则![]() 的
的![]() ________(用含
________(用含![]() 、
、![]() 、
、![]() 的代数式表示)。
的代数式表示)。
⑵若在恒温恒容条件下,仅发生反应![]() 。
。
①下列说法正确的是________(填字母)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加![]() 的量,平衡正向移动
的量,平衡正向移动
②达到平衡时![]() 的浓度为1.4 mol·L1,充入一定量的
的浓度为1.4 mol·L1,充入一定量的![]() ,反应再次达到平衡,
,反应再次达到平衡,![]() 浓度________(填“
浓度________(填“![]() ”“
”“![]() ”或“
”或“![]() ”) 1.4 mol·L1。
”) 1.4 mol·L1。
⑶在![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() ,若仅发生反应:
,若仅发生反应: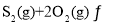
![]() ,
,![]() 后反应达到平衡,此时容器压强为起始时的80%,则
后反应达到平衡,此时容器压强为起始时的80%,则![]() 内,
内,![]() 的反应速率为________
的反应速率为________![]() 。
。
⑷在恒容密闭容器中,加入足量的![]() 和
和![]() ,仅发生反应:
,仅发生反应:![]()
![]()
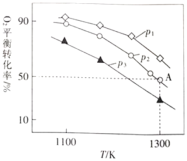
![]() 。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
①![]() ________(填“
________(填“![]() ”“
”“![]() ”或“
”或“![]() ”)0;比较
”)0;比较![]() 、
、![]() 、
、![]() 的大小:________。
的大小:________。
②若初始时通入![]() ,
,![]() 为
为![]() ,则
,则![]() 点平衡常数
点平衡常数![]() ________(用气体平衡分压代替气体平衡浓度计算,分压
________(用气体平衡分压代替气体平衡浓度计算,分压![]() 总压
总压![]() 气体的物质的量分数,写出计算式即可)。
气体的物质的量分数,写出计算式即可)。
【答案】![]() ab
ab ![]() 0.05
0.05 ![]()
![]() >
>![]() >
>![]() ;
; ![]()
【解析】
⑴根据盖斯定律计算焓变。
⑵①根据化学平衡状态的特征进行判断,根据影响平衡移动的因素分析;②根据平衡常数公式及平衡常数不变来分析。
⑶三步走建立关系,再根据压强之比等于物质的量之比计算,再计算S2(g)的反应速率。
⑷①利用温度变化,平衡移动来分析焓变;利用转化率的变化来分析压强变化;②建立三段式,根据压强之比等于物质的量之比计算平衡压强,再根据压强平衡常数进行计算。
⑴根据盖斯定律:第1个方程式的2倍加上第2个方程式的2倍,再加上第3个方程式,因此则![]() 的
的![]()
![]() ;故答案为:
;故答案为:![]() 。
。
⑵若在恒温恒容条件下,仅发生反应![]() 。
。
①a. 密度等于气体质量除以容器体积,正向反应,气体质量增加,容器体积不变,当气体的密度不变,则反应一定达到了平衡状态,故a正确;b. 该反应只有S2(g)是气体,气体的相对分子质量始终不变,因此反应不一定处于平衡状态,故b正确;c. 增加MoS2的量,MoS2是固体,平衡不移动,故c错误;综上所述,答案为:ab。
②达到平衡时S2(g)的浓度为1.4 mol·L1,充入一定量的S2(g),根据平衡常数公式及平衡常数不变,反应再次达到平衡,S2(g)浓度= 1.4 mol·L1;故答案为:=。
⑶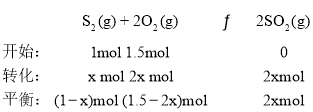 ,根据压强之比等于物质的量之比得到
,根据压强之比等于物质的量之比得到![]() ,得到x = 0.5,则
,得到x = 0.5,则![]() 内,S2(g)的反应速率为
内,S2(g)的反应速率为![]() ;故答案为:0.05。
;故答案为:0.05。
⑷①温度升高,氧气转化率降低,说明平衡逆向移动,逆向是吸热反应,正向是放热反应即ΔH <0;该反应是体积减小的反应,在1300K,从下到上,氧气转化率越来越大,说明是正向移动即加压,因此![]() >
>![]() >
>![]() ;故答案为:
;故答案为:![]() >
>![]() >
>![]() 。
。
② ,根据压强之比等于物质的量之比得到
,根据压强之比等于物质的量之比得到![]() ,P(平衡) = 5.5kPa,则A点平衡常数
,P(平衡) = 5.5kPa,则A点平衡常数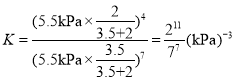 ;故答案为:
;故答案为:![]() 。
。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】在容积为2L的恒容密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图1表示200℃时容器中A、B、C的物质的量随时间的变化关系,图2表示不同温度下达到平衡时C的体积分数随起始
zC(g),图1表示200℃时容器中A、B、C的物质的量随时间的变化关系,图2表示不同温度下达到平衡时C的体积分数随起始![]() 的变化关系。则下列结论正确的是( )
的变化关系。则下列结论正确的是( )
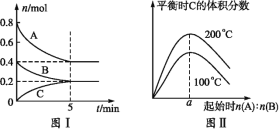
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
B.由图2可知反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
C.若在图1所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2molA和1molB,达到平衡时,A的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯胺为无色液体,还原性强,易被氧化,有碱性,与酸反应生成盐,硝基苯与氢气制备苯胺(沸点为184℃)的反应原理如下:
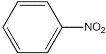 +3H2
+3H2![]()
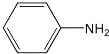 +2H2O
+2H2O
某同学设计的制备实验装置(部分夹持装置省略)如图:
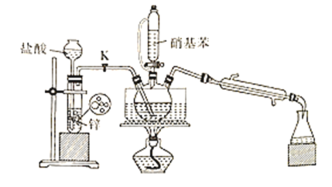
下列说法正确的是( )
A.仅用上述装置图中仪器就可以完成该实验
B.用硝酸代替盐酸,反应速率更快,实验效果较好
C.点燃酒精灯前,打开K,先通一段时间的H2
D.三颈烧瓶内的反应结束后,关闭K,先在三颈烧瓶中加入浓硫酸后蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列叙述正确的是( )
为阿伏加德罗常数的值,下列叙述正确的是( )
A.![]() 由
由![]() 与
与![]() 组成的混合物中所含的质子总数为
组成的混合物中所含的质子总数为![]()
B.![]() 和
和![]() 所含的氢原子数均为
所含的氢原子数均为![]()
C.![]() 溶液在沸水中生成的胶体粒子数为
溶液在沸水中生成的胶体粒子数为![]()
D.![]() 乙醇与
乙醇与![]() 乙酸在浓硫酸的作用下充分反应,生成乙酸乙酯的数目为
乙酸在浓硫酸的作用下充分反应,生成乙酸乙酯的数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是石蜡油在炽热碎瓷片的作用下产生乙烯并检验乙烯性质的实验,请回答下列问题:

(1)A中碎瓷片的作用是________。
(2)B装置中反应的化学方程式为__________。
(3)C装置中可观察到的现象是_________。
(4)查阅资料.乙烯与酸性高锰酸钾溶液反应产生二氧化碳,根据本实验中装置_____(填装置字母)中的实验现象可判断该资料是否直实。
(5)通过上述实验探究,检验甲烷和乙烯的方法是_______(填字母,下同),除去甲烷中乙烯的方法是___。
A 气体通入水中 B 气体通过盛溴水的洗气瓶
C 气体通过盛酸性高锰酸钾溶液的洗气瓶 D 气体通过氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行X2(g)+4Y2(g)![]() 2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是 ( )
2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是 ( )
A.c(X2)=0.15mol·L-1B.c(Y2)=0.9mol·L-1
C.c(Z2)=0.3mol·L-1D.c(Q2)=0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚硫酸钠晶体与浓硫酸反应可以产生二氧化硫,按下图进行演示实验。
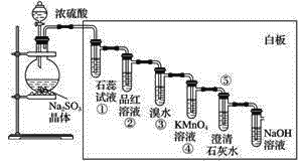
请回答下列问题:
(1)①中的实验现象是__________,说明二氧化硫具有的性质是__________。
(2)②中的实验现象是__________,证明二氧化硫有___________性。
(3)③中的实验现象是_______________,证明二氧化硫有____________性。
(4)④中的实验现象是__________,证明二氧化硫有______性。
(5)⑤中的实验现象是_____________,说明二氧化硫具有的性质是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为用惰性电极电解制备高锰酸钾的装置示意图如下。下列说法正确的是
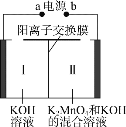
A.a为电源正极
B.Ⅰ中的K+通过阳离子交换膜移向Ⅱ
C.若不使用离子交换膜,KMnO4的产率可能会降低
D.若阴极产生0.2 mol气体,理论上可得到0.2 mol KMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,FePO4作为制备锂离子电池正极材料LiFePO4的重要原料而成为研究热点。一种以FeCl3、H3PO4、氨水为主要原料制备FePO4的流程如下图。

已知:H3PO4是弱电解质
(1)将FeCl3溶液与H3PO4溶液按![]() 混合,没有明显现象,逐渐滴加氨水至pH = 1.5左右,生成FePO4·2H2O沉淀。
混合,没有明显现象,逐渐滴加氨水至pH = 1.5左右,生成FePO4·2H2O沉淀。
①操作a为______。
②生成FePO4·2H2O的离子方程式是______。
③控制氨水用量,避免因pH偏高而产生______杂质。
(2)测定产物样品中铁元素的质量分数,主要步骤如下:
i.取a g样品,加入过量盐酸充分溶解,再滴加SnCl2(还原剂)至溶液呈浅黄色;
ii.加入TiCl3,恰好将i中残余的少量Fe3+还原为Fe2+;
iii.用c mol·L–1 K2Cr2O7标准溶液滴定Fe2+,消耗v mLK2Cr2O7标准溶液。
①将步骤iii的离子方程式补充完整:
____![]() +____Fe2++___=____Cr3++____Fe3++____;
+____Fe2++___=____Cr3++____Fe3++____;
②产物中铁元素的质量分数为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com