
【题目】下列说法中正确的是( )
A.已知石墨比金刚石稳定,则反应C(石墨,s)=C(金刚石,s)为放热反应
B.物质发生化学反应时都伴随能量变化,则伴随能量变化的物质变化也一定是化学变化
C.相同条件下,如果1mol氧原子所具有的能量为E1,1mol氧分子所具有的能量为E2,则2E1=E2
D.已知![]()
![]() ,
,![]()
![]() ,则
,则![]()
【答案】D
【解析】
A.物质的能量越低,物质的稳定性就越强,石墨比金刚石稳定,说明石墨的能量比金刚石低,则反应C(石墨,s)=C(金刚石,s)为吸热反应,A错误;
B.物质发生化学反应时都伴随能量变化,则伴随能量变化的物质变化不一定是化学变化,如浓硫酸的稀释放出热量,但发生的是物理变化,B错误;
C.原子形成化学键结合为分子时,放出热量,说明原子具有的能量比分子多,相同条件下,如果1mol氧原子所具有的能量为E1,1mol氧分子所具有的能量为E2,则2E1>E2,C错误;
D.因为气态碘的能量高于固态碘,相同物质的量的气态碘和固态碘分别和氢气发生反应时,气态碘放热更多,焓变更小,已知![]()
![]() ,
,![]()
![]() ,则
,则![]() ,D正确;
,D正确;
故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某校课外活动小组为了探究铜与稀硝酸反应产生的是NO气体,设计了如下实验。实验装置如图所示(已知NO、NO2能与NaOH溶液反应):
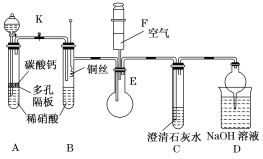
(1)设计装置A的目的是____________________________;
(2)在(1)中的操作后将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是____________________;B中反应的离子方程式是_______________________。
(3)装置E和F的作用是______________________________。
(4)D装置的作用是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印刷电路板(PCB)是用腐蚀液将覆铜板上的部分铜腐蚀掉而制得。一种用FeCl3溶液制作PCB并将腐蚀后废液回收再生的流程如图:
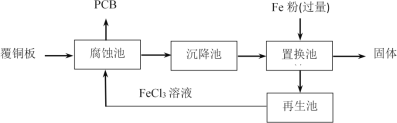
下列说法不正确的是( )
A.腐蚀池中发生反应的化学方程式是:Cu+2FeCl3=CuCl2+2FeCl2
B.腐蚀后的废液中,主要的金属阳离子有Fe3+、Cu2+、Fe2+
C.置换池中发生的主要反应为:Fe+Cu2+=Cu+Fe2+和Fe+2Fe3+=3Fe2+
D.再生池中加入酸化的H2O2,反应过程中pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)按官能团的不同,可以对有机物进行分类,请写出下列有机物的种类:
① CH3CH2CH2COOH ________; ② ![]() _________;
_________;
③ CH3CH2CHO _____________; ④ ![]() ________________。
________________。
(2)请用系统命名法命名下列有机物:
① CH3C(CH3)2CH2CH3 ________ ②![]() _________ ③
_________ ③  __________
__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的化学资源宝库,利用海水可以获取很多物质。海水中主要离子有Na+、K+、Ca2+、Mg2+、Cl-、SO42-等。
利用1:淡水工业
(1)海水淡化的方法主要有__、电渗析法、离子交换法等。
(2)电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示。
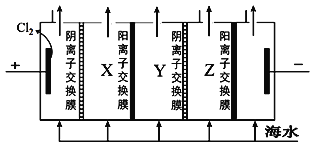
①淡水在__室(填X、Y或Z)形成后流出。
②一般海水不直接通入到阴极室中,原因是______________。
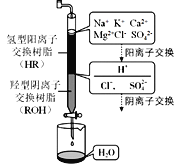
(3)离子交换法净化海水模拟过程如图所示,氢型阳离子交换原理可表示为:HR+Na+=NaR+H+,……。羟型阴离子交换树脂填充段存在的反应有______________。
利用2:提溴工业
(4)用海水晒盐之后的盐卤可提取溴,提取流程如图:

①用热空气将溴赶出,在吸收塔先用浓Na2CO3溶液吸收Br2,Br2歧化为Br-和BrO3-,再加入W溶液得到Br2。推测W是______________。
②蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是____________。
③将1m3海水浓缩至1L,使用该法最终得到38.4gBr2,若总提取率为60%,则原海水中溴的浓度是__mg/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二环[1,0,0]丁烷(![]() )是最简单的桥环化合物。下列关于该化合物的说法错误的是
)是最简单的桥环化合物。下列关于该化合物的说法错误的是
A. 该化合物的二溴代物有4种
B. 生成1molC4H10需要2molH2
C. 该化合物与1,3-丁二烯互为同分异构体
D. 该化合物中4个碳原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,下列有关说法不正确的是( )
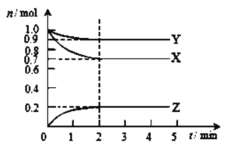
A.该反应的化学方程式为:3X+Y![]() 2Z
2Z
B.反应开始至2min,用Z表示的平均反应速率为:0.05mol·L﹣1·min﹣1
C.混合气体的总质量不随时间的变化而变化,说明反应已达化学平衡状态
D.平衡后X的转化率为30%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸氯(ClNO)是有机合成中的重要试剂。亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) ΔH1
2NaNO3(s)+2NO(g)+Cl2(g) ΔH1
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) ΔH2
NaNO3(s)+ClNO(g) ΔH2
③2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH3
2ClNO(g) ΔH3
则ΔH1、ΔH2、ΔH3之间的关系为ΔH3=____________。
(2)已知几种化学键的键能数据如表(亚硝酸氯的结构为Cl-N=O,一氧化氮的结构为N≡O)
化学键 | N≡O | Cl-Cl | Cl-N | N=O |
键能/kJ mol-1 | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g)![]() 2ClNO(g)反应的ΔH=_________kJ ·mol-1
2ClNO(g)反应的ΔH=_________kJ ·mol-1
(3)T℃时,2NO(g)+Cl2(g) ![]() 2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/mol·L-1 | υ/mol·L-1· s-1 |
① | 0.30 | 3.6×10-8 |
② | 0.60 | 1.44×10-7 |
③ | 0.90 | 3.24×10-7 |
n=__________;k=___________(注明单位)。
(4)在2 L的恒容密闭容器中充入4mol NO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图。
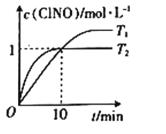
①由图可知T1、T2温度的速率υ1______υ2温度T1______T2。(填>、<或=)
②温度为T1时,能作为该反应达到平衡的标志的有__________。
a.气体体积保持不变 b.容器压强保持不变 c.气体颜色保持不变 d.υ(ClNO)=υ(NO) e.NO与ClNO的物质的量比值保持不变
③反应开始到10min时,Cl2的平均反应速率υ(Cl2)=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化白藜芦醇W具有抗病毒等作用。下面是利用Heck反应合成W的一种方法:
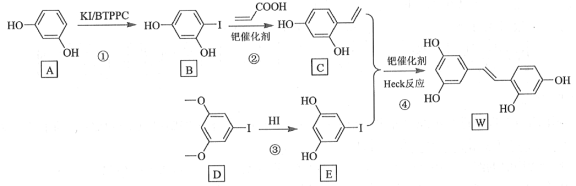
回答下列问题:
(1)A的化学名称为___________。
(2)![]() 中的官能团名称是___________。
中的官能团名称是___________。
(3)反应③的类型为___________,W的分子式为___________。
(4)不同条件对反应④产率的影响见下表:
实验 | 碱 | 溶剂 | 催化剂 | 产率/% |
1 | KOH | DMF | Pd(OAc)2 | 22.3 |
2 | K2CO3 | DMF | Pd(OAc)2 | 10.5 |
3 | Et3N | DMF | Pd(OAc)2 | 12.4 |
4 | 六氢吡啶 | DMF | Pd(OAc)2 | 31.2 |
5 | 六氢吡啶 | DMA | Pd(OAc)2 | 38.6 |
6 | 六氢吡啶 | NMP | Pd(OAc)2 | 24.5 |
上述实验探究了________和________对反应产率的影响。此外,还可以进一步探究________等对反应产率的影响。
(5)X为D的同分异构体,写出满足如下条件的X的结构简式________________。
①含有苯环;②有三种不同化学环境的氢,个数比为6∶2∶1;③1 mol的X与足量金属Na反应可生成2 g H2。
(6)利用Heck反应,由苯和溴乙烷为原料制备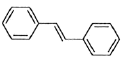 ,写出合成路线________________。(无机试剂任选)
,写出合成路线________________。(无机试剂任选)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com