
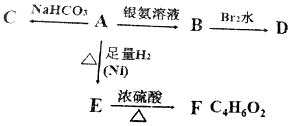
分析 由F可知A含有4个C原子,A可与碳酸氢钠反应,应含有羧基,可与银氨溶液反应,说明含有醛基,氧化产物B可与溴水反应,应含有C=C键,且D无支链,则A应为HOOCCH=CHCHO,由转化关系可知C为NaOOCCH=CHCHO,B为NH4OOCCH=CHCOONH4,D为HOOCCHBrCHBrCOOH,A发生加成反应生成E为HOOCCH2CH2CH2OH,F应为环丁内酯,以此解答该题.
解答 解:由F可知A含有4个C原子,A可与碳酸氢钠反应,应含有羧基,可与银氨溶液反应,说明含有醛基,氧化产物B可与溴水反应,应含有C=C键,且D无支链,则A应为HOOCCH=CHCHO,由转化关系可知C为NaOOCCH=CHCHO,B为NH4OOCCH=CHCOONH4,D为HOOCCHBrCHBrCOOH,A发生加成反应生成E为HOOCCH2CH2CH2OH,F应为环丁内酯,环丁内酯的结构简式为: ,
,
答:A为HOOCCH=CHCHO,B为NH4OOCCH=CHCOONH4,C为NaOOCCH=CHCHO,D为HOOCCHBrCHBrCOOH,E为HOOCCH2CH2CH2OH,F为 .
.
点评 本题考查有机物的推断,为高考常见题型,侧重考查学生的分析能力,掌握官能团的性质与转化是关键,对学生的逻辑推理有较高的要求,难度中等.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作步骤 | 实验现象 | 结论 |
| 取一定量的雾霾固体于试管中,加入适量的水溶解,把溶液分成两份. | ||
| 一份加入足量稀盐酸后,再加入BaCl2溶液. | 有白色沉淀生成. | 证明雾霾固体中含有SO42- |
| 另一份加入适量的NaOH浓溶液并加热. | 产生使湿润的红色石蕊试纸变蓝色的气体. | 证明雾霾固体中含有NH4+.综合上面实验,说明雾霾固体颗粒中含有(NH4)2SO4. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>X>Y>Z>M | |
| B. | XZ2为直线形的共价化合物 | |
| C. | X、Y、Z 分别与M元素形成的最简单化合物的沸点依次升高 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定含有离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 0.1mol/L NaClO溶液/mL | 0.1mol/L NaCl溶液/mL | 0.2mol/L NaOH溶液/mL | H2O/mL | 品红溶液 | 现象 |
| ① | 4.0 | 0 | 0 | 4.0 | 3滴 | 较快褪色 |
| ② | 0 | 4.0 | 4.0 | 0 | 3滴 | 不褪色 |
| ③ | 4.0 | 0 | 4.0 | 0 | 3滴 | 缓慢褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:P4(白磷,s)═4P(红磷,s),△H<0,则白磷比红磷稳定 | |
| B. | 由S (s)+O2(g)═SO2(g) (g)△H=-296.8 kJ•mol-1可知硫的标准燃烧热为296.8 kJ•mol-1 | |
| C. | OH-(aq)+H+(aq)═H2O(l)△H=-57.3 kJ•mol-1,故1 mol醋酸与1 mol NaOH完全反应,放出的热量为57.3 kJ•mol-1 | |
| D. | 甲醇燃料电池中,通入甲醇的一极为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Z | |
| Y | W |
| A. | X是第ⅢA元素,Z是第ⅤA元素 | |
| B. | 原子半径大小关系:r(Y)<r(W) | |
| C. | Y的气态氢化物比Z的气态氢化物稳定 | |
| D. | X、Y、W三种元素的最高化合价依次升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com