
【题目】按要求填空
(1)已知实验室制备氧气可以通过加热高锰酸钾实现,其发生的反应如下:2KMnO4 ![]() K2MnO4+MnO2+O2↑其中被氧化的元素是 , 还原产物是 .
K2MnO4+MnO2+O2↑其中被氧化的元素是 , 还原产物是 .
(2)查阅资料可知:铜和浓H2SO4共热,发生如下反应:Cu+2H2SO4 ![]() CuSO4+SO2↑+2H2O该反应中氧化剂与还原剂的物质的量之比为 , 其中H2SO4在反应中体现性.
CuSO4+SO2↑+2H2O该反应中氧化剂与还原剂的物质的量之比为 , 其中H2SO4在反应中体现性.
(3)在一定条件下,RO3n﹣和氟气可发生如下反应:RO3n﹣+F2+2OH﹣=RO4﹣+2F﹣+H2O从而可知在RO3n﹣中元素R的化合价是 .
(4)请用双线桥表示下列反应方程式中转移的电子数目及方向:
K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O
若反应中,发生氧化反应的HCl为1.2mol,则被还原的K2Cr2O7物质的量为 mol.
【答案】
(1)O;K2MnO4、MnO2
(2)1:1;氧化、酸
(3)+5
(4)0.2
【解析】解:(1)反应中Mn元素化合价由+7价分别降低为+6价、+4价,KMnO4为氧化剂,K2MnO4、MnO2为还原产物,O元素化合价升高,O2为氧化产物,所以答案是:O;K2MnO4、MnO2;(2)反应中Cu为还原剂,H2SO4为氧化剂,2molH2SO4中只有1mol作氧化剂,则氧化剂与还原剂的物质的量之比为1:1,硫酸在反应起到氧化剂和酸性的作用,所以答案是:1:1;氧化、酸;(3)根据电荷守恒可知,﹣n﹣2=﹣1﹣2,解得n=1.
令中R元素的化合价为a,离子中各元素化合价代数和等于离子的所带电荷,则:
a+(﹣2)×3=﹣1
解得:a=+5,
所以答案是:+5;(4)氧化还原反应K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O中,化合价升高元素Cl失电子,化合价降低元素Cr得电子,得失电子数目相等=反应中转移电子数=6,电子转移情况如下所示: 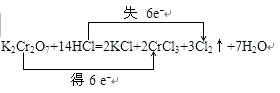 ,若反应中,假设有14molHCl参加反应,有6molHCl被氧化,所以发生氧化反应的HCl为1.2mol,则被还原的K2Cr2O7物质的量
,若反应中,假设有14molHCl参加反应,有6molHCl被氧化,所以发生氧化反应的HCl为1.2mol,则被还原的K2Cr2O7物质的量 ![]() =0.2mol,
=0.2mol,
所以答案是: 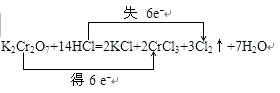 ;0.2mol.
;0.2mol.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】写下列反应的离子方程式。
(1)Na2CO3溶液与盐酸的反应:___________________。
(2)Ba(OH)2溶液与CuSO4的反应:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)防治环境污染,改善生态环境已成为全球的共识。
①空气质量报告的各项指标能体现空气的质量。下列各项指标不需要监测的是___________。
A.可吸入颗粒物(PM2.5) B.NO2浓度 C.SO2浓度 D.CO2浓度
②下列措施有利于改善环境质量的是___________。
A.将废电池深埋,以减少重金属的污染
B.将地沟油回收再加工为食用油,以减缓水体富营养化
C.利用二氧化碳等原料合成聚碳酸酯类可降解塑料代替聚乙烯
(2)采取适当的措施能减少对环境的污染。
①酸雨是指pH___________的降水,大量燃烧含硫煤产生气体随雨水降落到地面,pH随时间变长会有所减小,试用化学方程式解释其原因___________。
②一氧化碳也是常见的大气污染物。汽油在汽车发动机中的不完全燃烧可表示为2C8H18+23O2![]() 12CO2+4CO+18H2O
12CO2+4CO+18H2O
某环境监测兴趣小组的同学描绘的市中心地区空气中CO含量变化曲线(横坐标表示北京时间0到24小时,纵坐标表示CO含量),你认为比较符合实际的是____________。

A B C D
③天然水中含有的细小悬浮颗粒可以用___________做混凝剂(写名称)进行净化处理。工业废水中含有的Cr3+离子,可用熟石灰作沉淀剂,在pH为8至9时生成沉淀而除去,该反应的离子方程式是_____________。
(3)食品和药品关系人的生存和健康。
①市场上销售的食盐品种很多。下列食盐中,所添加的元素不属于人体必需微量元素的是___________(填字母)。
A.加锌盐 B.加碘盐 C.加钙盐
②纤维素被称为“第七营养素”。食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质。从化学成分看,纤维素是一种___________(填字母)。
A.多糖 B.蛋白质 C.脂肪
③某同学感冒发烧,他可服用下列哪种药品进行治疗____________(填字母)。
A.麻黄碱 B.阿司匹林 C.抗酸药
(4)化学与材料密切相关。
①人工合成的塑料有多种,其中聚乙烯是常见的塑料制品,结构简式是___________。
②钢铁的腐蚀主要发生吸氧腐蚀,其正极的电极反应为___________。为防止轮船的船体在海水中被腐蚀,一般在船身连接_____________(填“锌块”或“铜块”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时.向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应PCl5 (g)![]() PCl3(g)+Cl2(g),经过一段时间后达到平衡,反应过程中测定的部分数据列于下表。下列说法正确的是
PCl3(g)+Cl2(g),经过一段时间后达到平衡,反应过程中测定的部分数据列于下表。下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A. 在前50s,PCl3的平均反应速率 v(PCl3)=0.0032mol/(L·s)
B. 达到平衡时,容器中的压强是起始时的1.2倍
C. 相同温度下,起始时向容器中充入1.0mo PCl5、0.20 mo1 PCl3和0.20 mo1 Cl2,反应达到平衡前v(正)>v(逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)已知实验室制备氧气可以通过加热高锰酸钾实现,其发生的反应如下:2KMnO4 ![]() K2MnO4+MnO2+O2↑其中被氧化的元素是 , 还原产物是 .
K2MnO4+MnO2+O2↑其中被氧化的元素是 , 还原产物是 .
(2)查阅资料可知:铜和浓H2SO4共热,发生如下反应:Cu+2H2SO4 ![]() CuSO4+SO2↑+2H2O该反应中氧化剂与还原剂的物质的量之比为 , 其中H2SO4在反应中体现性.
CuSO4+SO2↑+2H2O该反应中氧化剂与还原剂的物质的量之比为 , 其中H2SO4在反应中体现性.
(3)在一定条件下,RO3n﹣和氟气可发生如下反应:RO3n﹣+F2+2OH﹣=RO4﹣+2F﹣+H2O从而可知在RO3n﹣中元素R的化合价是 .
(4)请用双线桥表示下列反应方程式中转移的电子数目及方向:
K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O
若反应中,发生氧化反应的HCl为1.2mol,则被还原的K2Cr2O7物质的量为 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超细氧化镍(NiO)是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面。工业上常以Ni(NO3) 6H2O和[CO(NH2)2](尿素)为原料制备。
(1)Ni2+基态核外电子排布式为_____________。
(2)与NO3-离子互为等电子体的一种分子的分子式为__________。
(3)尿素分子中碳原子轨道的杂化类型为________,1mol尿素分子中含有的σ键的数目为______。
(4)C、N、O三种元素第一电离能由大到小的顺序为_________。
(5)NiO(氧化镍)晶体的结构与NaCl相同,但天然的和绝大部分人工制备体都存在各种缺陷,例如在某种NiO晶体中就存在如右图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。经测定某氧化镍样品中Ni3+与Ni2+的离子数之比为6:91,若该晶体的化学式为NixO,则x=________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)1.5mol HNO3约含有个氧原子,含0.6mol H 的C6H12O6的物质的量是mol.
(2)22克CO2的物质的量为mol,该气体在标准状况下的体积为L.
(3)4gNaOH固体的物质的量为mol,将其溶于水配成500mL溶液,此溶液中NaOH的物质的量浓度为 .
(4)将5mol/L盐酸10mL稀释到200mL,稀释后溶液的物质的量浓度是 .
(5)实验室制备Fe (OH)3胶体的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸铵[(NH4)2CO3]在室温下就能自发地分解产生氨气,对其说法正确的是
A. 碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大
B. 碳酸铵分解是因为外界给予了能量
C. 碳酸铵分解是吸热反应,根据能量判据不能自发分解
D. 碳酸盐都不稳定,都能自发分解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com