
| A. | 1molCH3+(甲基碳正离子)含有的电子数目为9NA | |
| B. | 27g Al在标准状况下的22.4L Cl2中燃烧,转移的电子总数为3 NA | |
| C. | 0.2 mol•L-1的Na2CO3溶液中含有CO32-的数目一定小于0.2NA | |
| D. | 7.8gNa2S和Na2O2的混合物中含有的阴离子总数为0.1 NA |
分析 A、依据阳离子是失去电子形成的分析;
B.根据铝和氯气的物质的量判断过量,然后根据不足的计算转移的电子数;
C.溶液体积不知不能计算溶液中微粒数;
D.过氧化钠中的阴离子为过氧根离子,硫化钠和过氧化钠的摩尔质量都是78g/mol;
解答 解:A、1 mol CH3+含有的电子数目=1mol×(6+1×3-1)=8mol,含有的电子数目为8NA,故A错误;
B.27g铝的物质的量为1mol,完全反应消耗1.5mol氯气;而标况下22.4L氯气的物质的量为1mol,说明氯气不足,所以反应转移的电子的物质的量为2mol,转移的电子总数为2NA,故B错误;
C.溶液体积不知,0.2 mol•L-1的Na2CO3溶液中含有CO32-的数目不能确定,故C错误;
D.7.8g Na2S和Na2O2的物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,过氧化钠中阴离子为过氧根离子,硫化钠中阴离子为硫离子,则0.1mol混合物中含有0.1mol阴离子,含有的阴离子数等于0.1NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确氧化还原反应过量判断,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 该合金中铜与镁的物质的量之比是2:1 | |
| B. | 被还原的硝酸的物质的量是0.12mol | |
| C. | 得到5.08g沉淀时,加入NaOH溶液的体积是700mL | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
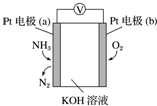 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )| A. | O2在电极b上发生还原反应 | |
| B. | 溶液中OH-向电极a移动 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| D. | 负极的电极反应式为2NH3-6e-+6OH-═N2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
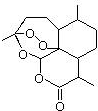
 ,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)
,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)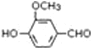 )可用于合成青蒿素,合成天然香草醛的反应如图:
)可用于合成青蒿素,合成天然香草醛的反应如图: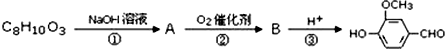
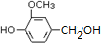 .
.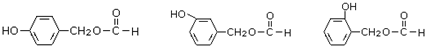 .
.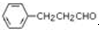 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).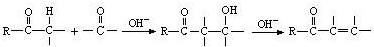
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
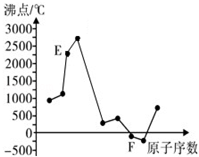 A、B、C、D、E、F是元素周期表中前20号元素,它们的原子序数依次增大.A、B可分别与C组成常见化合物AC、AC2、BC、BC2;D元素的焰色反应呈黄色;E、F两元素单质的沸点与元素原子序数的关系如图(图中原子序数连续).
A、B、C、D、E、F是元素周期表中前20号元素,它们的原子序数依次增大.A、B可分别与C组成常见化合物AC、AC2、BC、BC2;D元素的焰色反应呈黄色;E、F两元素单质的沸点与元素原子序数的关系如图(图中原子序数连续). ,化合物AC2的结构式O=C=O;C、D、F对应的简单离子半径由小到大的顺序为Na+<O2-<Cl-(用离子符号表示).
,化合物AC2的结构式O=C=O;C、D、F对应的简单离子半径由小到大的顺序为Na+<O2-<Cl-(用离子符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将1molH2(g)和2mol I2(g)置于某2L密闭容器中,在一 定温度下发生反应:H2(g)+I2(g)?2HI(g)△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如曲线如图(Ⅱ)所示.若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是( )
将1molH2(g)和2mol I2(g)置于某2L密闭容器中,在一 定温度下发生反应:H2(g)+I2(g)?2HI(g)△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如曲线如图(Ⅱ)所示.若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是( )| A. | 恒温恒容加入适当催化剂 | B. | 恒温条件缩小体积 | ||
| C. | 恒容条件下升高温度 | D. | 恒温条件扩大反应容器 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com