
【题目】
(1)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g) + 5O2(g) = 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:C3H8(g) = C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) = 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2 (g) = 2H2O(l) ΔH=-d kJ·mol-1 (abcd均为正值)
请回答下列问题:
①判断等量的丙烷通过两种途径放出的热量,途径I放出的热量(填“大于”、“等于”或“小于”)途径II放出的热量。
②b 与a、c、d的数学关系式是 。
(2)甲醇是一种重要的试剂,有着广泛的用途,工业上可利用CO2制备甲醇。用CH4与CO2反应制H2和CO,再利用H2和CO化合制甲醇。已知:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H1=-1450.0kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
③ 2H2(g)+O2(g)=2H2O(l) △H3=-571.6kJ·mol-1
则H2和CO制液态甲醇的热化学方程式为。
(3)如图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.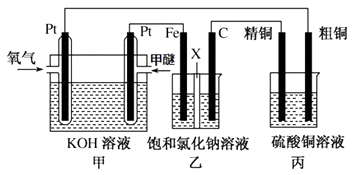
报据要求回答相关问题:
①写出甲中通甲醚一极的电极反应式。
②乙中发生的总反应的离子方程式为。
③将0.2mol AgNO3、0.4mol Cu(NO3)2 、0.6mol KCl溶于水,配成100ml溶液,用惰性电极电解一段时间后,某一电极上析出了0.3mol Cu,此时在另一电极上产生的气体体积(标准状况)为 L,若要使电解质溶液恢复到电解前的状态,需要加入固体的质量为g 。
【答案】
(1)等于,b= ![]() +
+ ![]() -a
-a
(2)CO(g)+2H2(g)=CH3OH(l) △H=-129.6kJ/mol
(3) CH3OCH3 -12e- + 16OH- = 2CO32-+ 11H2O,2Cl-+2H2O ![]() Cl2↑+H2↑+2OH-,5.6,35
Cl2↑+H2↑+2OH-,5.6,35
【解析】(1)①根据盖斯定律,煤作为燃料不管是一步完成还是分两步完成,反应物和产物的焓值是一定的,所以两途径的焓变值一样,放出的热量一样,所以途径I放出的热量等于途径II放出的热量;
②途径I:①C3H8(g) + 5O2(g) = 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:②C3H8(g) = C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
③2C3H6(g)+ 9O2(g) = 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1
④2H2(g)+O2 (g) = 2H2O(l) ΔH=-d kJ·mol-1 (abcd均为正值)
反应①=反应②+反应③× ![]() +反应④×
+反应④× ![]() ,所以-a=b+
,所以-a=b+ ![]() (-c-d),所以b=-a+
(-c-d),所以b=-a+ ![]() (c+d);
(c+d);
(2)① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H1=-1450.0kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
③ 2H2(g)+O2(g)=2H2O(l) △H3=-571.6kJ·mol-1
根据盖斯定律,②× ![]() +③-①×
+③-①× ![]() 得H2和CO制液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l) △H=-129.6kJ/mol;
得H2和CO制液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l) △H=-129.6kJ/mol;
(3)①甲醚燃料电池,甲醚在负极失电子生成碳酸根离子和水,电极反应式是CH3OCH3 -12e- + 16OH- = 2CO32-+ 11H2O;
②乙池有外接电源属于电解池,铁电极连接原电池的负极,所以是阴极,则石墨是阳极,阳极上氯离子放电生成氯气,阴极上是水电离的氢离子放电生成氢气,总反应是2Cl-+2H2O ![]() Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;
③将0.2mol AgNO3、0.4mol Cu(NO3)2 、0.6mol KCl溶于水,配成100ml溶液,三种物质溶于水时,AgNO3与KCl反应后溶液中含有0.2 mol KNO3、0.4 mol Cu(NO3)2和0.4 mol KCl。用惰性电极电解,析出了0.3mol Cu,阴极反应是:Cu2++2e-=Cu,阴极生成铜0.3mol,阴极转移电子的总物质的量是0.3×2=0. mol;阳极先后发生反应有2Cl--2e-=Cl2、4OH--4e-=2H2O+O2、;溶液中共0.4mol Cl-,阳极生成氯气0.2mol,设生成氧气xmol,根据电子守恒,4x+0.4=0.6,则x=0.05mol,所以生成气体的体积(0.2+0.05)mol×22.4L/mol=5.6L 。若要使电解质溶液恢复到电解前的状态,需要加入固体的质量为0.3mol×64g/mol+0.2mol×71g/mol+0.05×32g/mol=35g。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题: 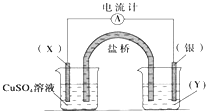
(1)电极X的材料是 , 电解质溶液Y是;
(2)银电极为电池的极,发生的电极反应为 X电极上发生的电极反应为 .
(3)外电路中的电子是从电极流向电极.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如图所示的装置进行原电池原理的探究。下列叙述错误的是

A. a和b不连接时,锌片上有气体生成,该装置不能形成原电池
B. a和b用导线连接时铜片为正极,发生的反应式为:2H++2e-=H2↑
C. a和b用导线连接时,电子由Zn经导线流向Cu,再经稀硫酸流回Zn
D. 无论a和b是否连接,稀硫酸均参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2、NO2能形成酸雨,某同学以它们为主题设计了两组实验:
(实验一)用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中.分别缓慢通入适量O2或Cl2,如图A、B、C所示。一段时间后,A、B装置的集气瓶中充满溶液(假设瓶内液体不扩散),C装置的集气瓶中还有气体剩余(考虑液体的扩散) 。

(1)写出装置A中总反应的化学方程式_____________________________,假设该实验条件下,气体摩尔体积为a L/mol,则装置A的集气瓶中所得溶液溶质的物质的量浓度为______________。
(2)写出B装置的溶液充满集气瓶时,有关反应的离子方程式_______________。
(3)实验前在C装置的水槽里滴加几滴紫色石蕊试液,通入氧气后,可观察到的实验现象是水槽中溶液___________________________(答颜色的变化),写出反应的总化学方程式____________________________________。
(实验二)利用上图B的原理,设计下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计用于准确测量通过的尾气体积。将尾气通入一定体积的碘水,并通过实验测定SO2的含量。当洗气瓶D中溶液蓝色刚好消失时,立即关闭活塞K。

(4)D中导管末端连接一个多孔球泡E,其作用是_______________________,可以提高实验的准确度。
(5)当流量计中刚好通过2L尾气时,D中溶液蓝色刚好消失,立即关闭活塞K,容器D中恰好得到100mL溶液,将该溶液全部转移至锥形瓶中,滴入过量BaCl2溶液,过滤、洗涤、干燥,得到4.66g 白色沉淀,通过计算可知,上述尾气中二氧化硫的含量为________g/L。若洗气瓶D中溶液蓝色消失后,没有及时关闭活塞K,测得的SO2含量_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作不是从安全角度考虑的是
A.用氯酸钾和二氧化锰制氧气时用排水法收集后,应从水中撤出导管后再停止加热
B.酒精灯在不使用时,必须盖上灯帽
C.实验室制备CO气体必须在通风橱中进行
D.蒸馏操作时应在混合液中加入沸石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、水的电离平衡曲线如图所示。
(1)若以A点表示25℃时水的电离平衡的离子浓度,当温度升高到100℃时,水的电离平衡状态移动到B点,则此时水的离子积从变化到。
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,致使混合溶液的pH=7,则Ba(OH)2和盐酸的体积比为。
Ⅱ、有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复):阳离子 Na+、Ba2+、NH4+ 阴离子 CH3COO-、Cl-、OH-、SO42-。已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
①A是 , B是 。
②用离子方程式表示A溶液呈碱性的原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 |
下列说法正确的是( )
A. 由实验数据可知实验控制的温度T2>T1
B. 组别①中,0~20min内,NO2的降解速率为0.0125mol·L-1·min-1
C. 40min时,表格中T2对应的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的说法错误的是( )
A.原电池是将化学能转化为电能的装置
B.原电池负极发生氧化反应
C.原电池中,阳离子向负极移动
D.原电池电子流出的一极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2N0+O2在密闭容器中反应,达到平衡状态的标志是( )
2N0+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : l 的状态
④混合气体的颜色不再改变的状态
A. ①④ B. ②③ C. ①③④ D. ①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com