
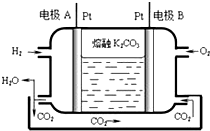
 一种新型氢氧燃料电池工作原理如图所示.
一种新型氢氧燃料电池工作原理如图所示.分析 (1)氢氧燃料电池的负极氢气发生氧化反应,正极上发生得电子的还原反应,据此书写电极反应;
(2)电解饱和食盐水,总反应为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,据电子守恒计算回答.
解答 解:(1)氢氧燃料电池的负极氢气发生氧化反应,电极反应为:H2-2e-+CO32-=CO2+H2O,故答案为:H2-2e-+CO32-=CO2+H2O;
(2)电解饱和食盐水,总反应为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,若生成0.2molCl2,转移电子是0.2mol,原电池正极上发生反应:O2+4e-+2CO2=2CO32-,所以需通入O2的体积为$\frac{0.2mol}{4}$×22.4L/mol=1.12L,故答案为:1.12L.
点评 本题考查电化学的相关知识,学生要掌握原电池的工作原理,以及在电子转移相等的情况下的有关计算,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 在化合物Na2O2中,阴、阳离子的个数比为1:1 | |
| C. | 在化合物CaCl2中,两个氯离子之间存在共价键 | |
| D. | 含有离子键的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 气体1可能为SO2和CO2的混合物 | |
| B. | 沉淀3可能为Al(OH)3 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3,可能有KAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ | B. | Al(OH)3 | C. | [Al(OH)4]- | D. | Al3+和Al(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com