
| A. | 环己烷的实验式:CH2 | B. | 四氯化碳分子的球棍模 型: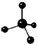 | ||
| C. | HCl的电子式: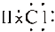 | D. | 氟原子的结构示意图: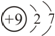 |
分析 A.实验式中C、H原子个数比为最简比;
B.四氯化碳分子中,氯原子的原子半径大于碳原子;
C.HCl属于共价化合物,分子中氢原子与氯原子之间形成1对共用电子对;
D.氟原子核内有9个质子,核外有2个电子层,第一层上有2个电子、第二层上有7个电子.
解答 解:A.环己烷为环烷烃,有一个碳环,不含有不饱和双键或三键,碳碳之间形成单键,结构简式为: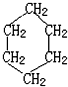 ,C、H原子个数比为CH2,所以实验式为:CH2,故A正确;
,C、H原子个数比为CH2,所以实验式为:CH2,故A正确;
B.四氯化碳中存在4个C-Cl键,为正四面体结构,氯原子的原子半径大于碳原子,四氯化碳正确的球棍模型为 ,故B错误;
,故B错误;
C.HCl属于共价化合物,不存在离子键,分子中氢原子与氯原子之间形成1对共用电子对,HCl电子式为 ,故C正确;
,故C正确;
D.氟原子核内有9个质子,核外有2个电子层,氟原子的结构示意图: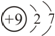 ,故D正确;
,故D正确;
故选B.
点评 本题考查了实验式、球棍模型、电子式、原子结构示意图的表示方法判断,题目难度不大,注意掌握常见的化学用语的概念及正确的表示方法,明确四氯化碳的球棍模型中原子半径比例大小,为易错点.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Uuo的原子序数为118 | B. | ${\;}_{118}^{297}Uuo$的核内中子数为179 | ||
| C. | ${\;}_{118}^{297}Uuo$的核外电子数为118 | D. | Uuo的相对原子质量为297 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有X、Y、W三种元素组成的化合物中既有离子键又有非极性共价键 | |
| B. | 简单离子半径由大到小的顺序是:Z>W>Y>X | |
| C. | 简单氢化物的沸点:W>Z,还原性:W>Z | |
| D. | Y、Z、W三元素形成的两种常见化合物的溶液中,水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥⑦⑧ | B. | ①②③④⑦ | C. | ①④⑥⑦ | D. | ①④⑥⑦⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④ | B. | 只有①③ | C. | 只有①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g 金刚石中含有的六元碳环数为NA | |
| B. | 1L1mol/L 的甲醇水溶液中含有氢原子总数为4NA | |
| C. | 12g 石墨和 C60的混合物中质子总数为6NA | |
| D. | 反应 KIO3+6HI=KI+3H2O+3I2中,生成1molI2转移电子的总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com