

| A. | y轴表示的可能是电离能 | |
| B. | y轴表示的可能是电负性 | |
| C. | y轴表示的可能是原子半径 | |
| D. | y轴表示的可能是形成基态离子转移的电子数 |
分析 由第三周期11~17号元素某些性质变化趋势的柱形图,可知随原子序数的增大,元素的非金属性增强、电负性增强,而原子半径减小,以此来解答.
解答 解:A.Mg的3s电子全满为稳定结构,P的3p电子半满为稳定结构,则电离能大于相邻的元素,故A错误;
B.随原子序数的增大,元素的非金属性增强,则元素的电负性增强,故B正确;
C.随原子序数的增大,原子半径减小,与图象不符,故C错误;
D.金属失去电子,而非金属得到电子,与图象不符,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握图中性质的变化规律、元素周期律为解答的关键,侧重分析与应用能力的考查,注意选项AD为解答的难点,题目难度不大.


 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| B. | 正四面体分子晶体内的键角一定是109°28′ | |
| C. | CuSO4溶液能使蛋白质溶液产生沉淀,该过程可用于提纯蛋白质 | |
| D. | NH3•H2O溶液加水稀释后,溶液中$\frac{c(N{H}_{3}{H}_{2}O)}{c(N{H}_{{4}^{+}})}$的值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
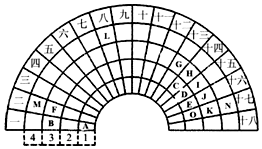 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题:
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题: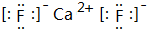 ,用电子式表示CJ2的形成过程:
,用电子式表示CJ2的形成过程: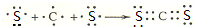 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Al3+<Mg2+<F-<O2- | B. | 热稳定性:SiH4>NH3>H2O>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:KOH>NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铯的密度比金属钠小 | B. | 金属铯的熔点比金属钠高 | ||
| C. | Cs与H2O能剧烈反应,甚至发生爆炸 | D. | 碳酸铯难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H2 | C. | C3H8 | D. | C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2在反应中作氧化剂,又作还原剂 | |
| B. | 高铁酸钾在该温度下的溶解度比高铁酸钠的溶解度小 | |
| C. | K2FeO4能消毒杀菌,其还原产物水解生成的Fe(OH)3胶体能吸附水中的悬浮物 | |
| D. | 制取高铁酸钠时,每生成1mol Na2FeO4反应中共有4mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制0.1 mol•L-1 NaCl溶液时,其中一步是将已准确称量的NaCl放入烧杯中并加适量的水搅拌溶解 | |
| B. | 配制1 mol•L-1 NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶 | |
| C. | 配制0.1 mol•L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 | |
| D. | 配制1 mol•L-1 Na2CO3溶液500 mL,将Na2CO3放在托盘天平右盘称量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com