
| 选项 | 目的 | 试剂或试验方法 | 说明 |
| A | 从苯中提溴 | 加CCl4 | 溴易溶于CCl4 |
| B | 检验含Fe3+溶液中是否含Fe2+ | 加高锰酸钾溶液 | 溶液紫色褪去,说明含Fe2+ |
| C | 配置1mol/LFeCl3溶液100mL | 将一定质量FeCl3溶液转移至容量瓶中加水定容 | 容量瓶规格须为100mL |
| D | 制取漂白粉 | 将氯气通入澄清石灰水中 | 氯气与氢氧化钙反应生成次氯酸钙 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.苯与四氯化碳互溶;
B.Fe2+、Cl-等还原性离子,可与高锰酸钾发生氧化还原反应;
C.配置1mol/LFeCl3溶液100mL,应用100mL容量瓶;
D.澄清石灰水浓度太低.
解答 解:A.苯与四氯化碳互溶,不能用四氯化碳除杂,应加入氢氧化钠溶液,故A错误;
B.Fe2+、Cl-等还原性离子,可与高锰酸钾发生氧化还原反应,不能证明含有亚铁离子,可加入溴水等氧化剂鉴别,故B错误;
C.配置1mol/LFeCl3溶液100mL,应用100mL容量瓶,故C正确;
D.澄清石灰水浓度太低,制备漂白粉,应用石灰乳与氯气反应,故D错误.
故选C.
点评 本题考查较为综合,涉及物质的分离、检验、溶液的配制以及物质的制备,为高频考点和常见题型,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及实验的严密性和可行性的评价,难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 铝和氢氧化钠溶液共热 | |
| B. | 氯化铝溶液中滴入过量氢氧化钾溶液 | |
| C. | 明矾溶液中滴入过量氨水 | |
| D. | 物质的量浓度相同的硝酸铝溶液和氢氧化钠溶液等体积混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨既是实验室中常用试剂,也是工业上重要原料.
氨既是实验室中常用试剂,也是工业上重要原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8 | B. | 6 | C. | 5 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
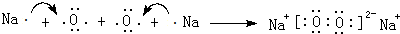 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠、氢氧化钠、氯化钡 | B. | 氯化钡、氢氧化钠、碳酸钠 | ||
| C. | 氢氧化钠、碳酸钠、氯化钡 | D. | 碳酸钠、氯化钡、氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 离O点越远的元素原子半径越大 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | A、B组成的化合物中阴阳离子的个数比都是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
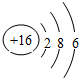 .
.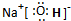 ,这种化合物形成的晶体中所含的化学键类型有离子键、共价键.
,这种化合物形成的晶体中所含的化学键类型有离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A. | E2-与B3+的核外电子数不可能相等 | |
| B. | 离子半径大小A+<E2- | |
| C. | 最高价氧化物对应水化物的碱性A<C | |
| D. | 氢化物的稳定性H2D>H2E |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com