
| A. | NaHSO4溶液与NaOH溶液混合 | B. | NH4Cl溶液与Ca(OH)2溶液混合 | ||
| C. | HNO3溶液与石灰乳混合 | D. | Na2HPO4溶液与NaOH溶液混合 |
分析 H++OH-=H2O表示可溶性强碱与强酸(或者可溶性强酸的酸式盐)反应生成可溶性盐和水,据此分析解答.
解答 解:A.NaHSO4溶液与NaOH溶液混合,二者反应实质是氢离子与氢氧根离子反应生成水,离子方程式:H++OH-=H2O,故A正确;
B.NH4Cl溶液与Ca(OH)2溶液混合,离子方程式:NH4++OH-=NH3•H2O,故B错误;
C.石灰乳中氢氧化钙应保留化学式,不能拆,离子方程式:2H++Ca(OH)2=2H2O+Ca2+,故C错误;
D.磷酸氢根离子为弱酸的酸式根离子,不能拆,离子方程式:HPO42-+OH-=H2O+PO43-,故D错误;
故选:A.
点评 本题考查了离子共存、离子方程式的书写判断,熟练掌握离子共存的条件、离子方程式的书写原则是解题关键,题目难度不大.


科目:高中化学 来源: 题型:推断题
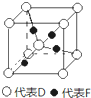 在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的1/4,F元素位于周期表的ds区,其基态原子最外能层只有一个电子.
在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的1/4,F元素位于周期表的ds区,其基态原子最外能层只有一个电子.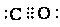 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
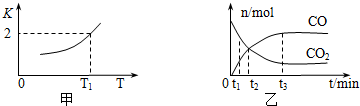
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8g CH4含有5NA个电子 | |
| B. | 标准状况下,22.4L氦气含有2NA个原子 | |
| C. | 常温常压下,22.4L CO2和SO2混合气体含有2NA个氧原子 | |
| D. | 46gNO2和N2O4的混合气体含氮原子数可能为1.5NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基戊烷也称为新戊烷 | B. | 由苯制取溴苯的反应属于加成反应 | ||
| C. | C2H4Br2有2种同分异构体 | D. | 乙醇和乙酸均为非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 键能 | 键能 | 键能 | |||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | ||
| S-S | 255 | H-S | 339 | C-F | 427 | ||
| C-Cl | 330 | C-I | 218 | H-F | 568 | ||
| C-O | 351 | H-O | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| H2和Cl2的物质的量关系 | n(H2)=n(Cl2) | n(H2)>n(Cl2) | n(H2)<n(Cl2) |
| 生成NaCl的物质的量 | amol(或bmol) | bmol | amol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池的电解质溶液为碱性溶液,阳离子向正极移动 | |
| B. | 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 | |
| C. | 电池充电过程中,阴极附近溶液的pH降低 | |
| D. | 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-═Ni2O3+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
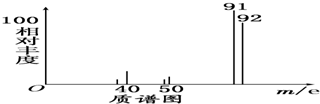
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com