
反应3NO2(g)+H2O(l)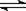 2HNO3(aq)+NO(g) △H<0达到平衡后,改变下列条件,可使HNO3浓度增大的是
2HNO3(aq)+NO(g) △H<0达到平衡后,改变下列条件,可使HNO3浓度增大的是
A.升温 B.减压 C.加水 D.通入O2
科目:高中化学 来源: 题型:
有物质的量浓度均为0.1 mol·L-1 的① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25 mL,,下列说法正确的是 ( )
A.3种溶液pH的大小顺序是 ③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25 mL 0.1 mol·L-1盐酸后,pH最大的是①
D.若升高温度,则②的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法中,正确的是( )
A.硅单质既不能与酸反应又不能与碱反应
B.硅在自然界中以化合态存在
C.硅与NaOH溶液的反应中,硅做氧化剂
D.硅元素在地壳中的含量居第一位
查看答案和解析>>
科目:高中化学 来源: 题型:
由阿伏加德罗常数和一个水分子的质量、一个水分子的体积,不能确定的物理量有( )
A.1摩尔水的质量 B.1摩尔水蒸气的质量
C.1摩尔水的体积 D.1摩尔水蒸气的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.放热反应一定不需要加热
B.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
C.使用催化剂不但能加快反应速率,而且可以让不可能发生的反应发生
D.难溶物也可能是强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组热化学方程式中,△H1 >△H2的是
A.C(s)+O2(g)===CO2(g) △H1 C(s)+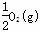 ===CO(g) △H2
===CO(g) △H2
B.S(g)+O2(g)===SO2(g) △H1 S(s)+O2(g)===SO2(g) △H2
C.2H2(g)+O2(g)===2H2O(l) △H1 H2(g)+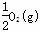 ===H2O(l) △H2
===H2O(l) △H2
D.CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)===Ca(OH)2(s) △H2
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,下列变化后的溶液pH小于8的是
A.pH=10的氨水稀释100倍
B.pH=11的NaOH溶液与pH=5的盐酸等体积混合
C.pH=8的NaOH溶液与pH=8的氨水等体积混合
D.pH=4的醋酸和pH=10的NaOH溶液等体积混合
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写中,正确的是 ( )
A.向Fe2(SO4)3溶液中加入少量铁粉:Fe3++Fe===2Fe2+
B.向稀硫酸中滴入少量Na2CO3溶液:2H++CO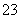 ===CO2↑+H2O
===CO2↑+H2O
C.铜放入氯化铁溶液中: Fe3++Cu===Fe+Cu2+
D.氯化铁溶液与氨水反应:Fe3++3OH-===Fe(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
I.铁及其化合物在生活、生产中有广泛应用。请回答下列问题。
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2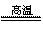 6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式: 。
(3)研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
①装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 。
②实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
③从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式
。
④装置D球形干燥管的作用 。
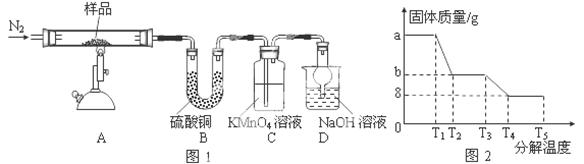
⑤某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4•xH2O中的x= 。
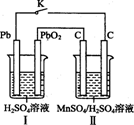 II.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为
II.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com