
【题目】请回答下列问题。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。

①100℃时1mol·L-1的NaOH溶液中,由水电离出的c(H+)=______mol·L-1,Kw(25℃)________Kw(100℃) (填“>”、“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量 NH4Cl固体,对水的电离平衡的影响是_____(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为_____________________;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+) c(CH3COO-) (填“>”、“<”或“=”);
【答案】(1)① 1×10-12 < ② 促进;(2)①c>a>b ② >;
【解析】试题分析:(1)25℃时纯水中c(H+)=c(OH-)=10-7mol/L,Kw=c(H+)c(OH-)=10-14 ,当温度升高到100℃,纯水中c(H+)=c(OH-)=10-6mol/L,Kw=c(H+)c(OH-)=10-12 ;
100℃时1molL-1的NaOH溶液中Kw=c(H+)c(OH-)=10-12 ;c(OH-)=1mol/L,水电离出的c(H+)=1×10-12;水电电离是吸热反应,温度升高,水的电离程度增大,Kw增大,因此Kw(25℃)<Kw(100℃) 。NH4Cl固体溶解后溶液中铵根离子水解生成一水合氨和氢离子,溶液呈酸性,水的电离被促进;故答案为:1×10-12;<;促进;
(2)①依据图表数据分析,醋酸电离常数大于氰酸大于碳酸氢根离子,所以等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度等浓度的Na2CO3溶液>NaCN溶液>CH3COONa溶液,溶液pH为Na2CO3溶液的>NaCN溶液的>CH3COONa溶液的;故答案为:Na2CO3溶液>NaCN溶液>CH3COONa溶液;
②等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,c(H+)<c(OH-)依据溶液中电荷守恒c(H+)+c(Na+)=c(OH-)+c(CH3COO-),c(Na+)>c(CH3COO-);故答案为:>。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述不正确的是
A. 标准状况下,0.56L 丙烷中含有共价键的数目为0.25NA
B. 常温常压下,6.4g氧气和臭氧的混合物中含有的原子总数为0.4NA
C. 5.6g铁与一定量硝酸恰好反应,转移的电子数目一定为0.3NA
D. 一定条件下,28gN2与6gH2反应,转移的电子数小于6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物N是一种重要材料的中间体,合成N的一种路线如下:
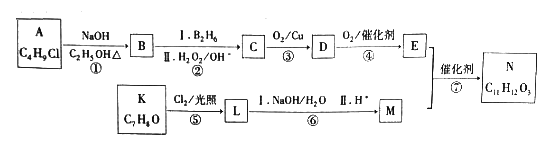
已知:i.一氯代烃A的核磁共振氢谱只有1种峰;
ii.芳香族化合物K遇FeCl3溶液显紫色,其核磁共振氢谱峰面积比为1∶2∶2∶3;
iii.N能发生水解和银镜反应;
iV.RCH=CH2![]() RCH2CH2OH;
RCH2CH2OH;
V.两个羟基连接在同一个碳原子上不稳定,易脱水。
请回答下列问题:
(1)B的结构简式是__________,C的化学名称是_________,D含有的官能团是__________。
(2)步骤①的反应类型是__________。
(3)下列说法不正确的是_________。
a.B和K都能发生氧化反应
b.1molC完全燃烧需6molO2
c.D能与新制氢氧化铜悬浊液反应
d.1molM最多能与3molH2反应
(4)步骤③的化学方程式为_______________________。
(5)步骤⑦的化学方程式为_______________________。
(6)L的同分异构体中苯环上有三个取代基且与L官能团相同的物质共有________种;N经催化氧化得到X(C11H12O4),X的同分异构体中同时满足下列条件的结构简式为___________________。
a.苯环上只有两个取代基,苯环上的一氯代物有2种
b.水解只生成芳香醇和二元酸,且二元酸中有2种不同化学环境的氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.钠在空气中燃烧时,先熔化,再燃烧,燃烧产物为Na2O2
B.镁因在空气中形成一薄层致密的氧化膜保护了里面的镁,故镁不需要像钠那样的特殊保护
C.铝制品在生活中非常普遍,是因为铝不活泼
D.铁因在潮湿的空气中生成的氧化物疏松多孔,不能保护内层金属,故铁制品往往需要涂保护层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应,在一定条件下,反应物至少有一种能完全反应的是
A. 过量的氢气与氮气 B. 过量的二氧化锰与浓盐酸
C. 过量的铜与浓硫酸 D. 过量的锌与18 mol/L硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品。
(2)将样品配成250mL待测液,需要的仪器除了小烧杯、玻璃棒、量筒还需要____________________。
(3)取10.00mL待测液,用___________________ 量取。
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,甲基橙做指示剂,滴定时左手旋转滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视____________,至出现______________的现象时即到达滴定终点。
(5)根据下列数据,计算待测烧碱的纯度:__________________。(保留四位有效数字)
滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 0.10 | 22.10 |
第三次 | 10.00 | 4.00 | 24.10 |
(6)以下操作会造成测量结果偏高的是(_________)
①用蒸馏水冲洗锥形瓶;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外;
③读数时,滴定前仰视,滴定后俯视;
④装标准液之前,没有用标准液润洗滴定管;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A.液态HCl不导电,但HCl属于电解质
B.NaHSO4溶于水电离出Na+、H+ 和SO42-,所以NaHSO4属于酸
C.氢氧化铁胶体和食盐水都属于混合物
D.Al(OH)3可用作胃酸中和剂,不会对胃壁产生强烈刺激
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中正确的是( )
A. 对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
B. 等质量的硫蒸气和固态硫单质分别完全燃烧,后者放出的热量多
C. 表示氢气燃烧热的ΔH为-285.8 kJ·mol-1,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)![]() 2H2O(l) ΔH=-285.8 kJ·mol-1
2H2O(l) ΔH=-285.8 kJ·mol-1
D. 已知中和热ΔH为-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
X | Y | Z | M | R | Q | |
原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1, +7 | +3 | ||
其他 | 阳离子核 外无电子 | 无机非金属 材料的主角 | 焰色反 应呈黄色 |
(1) R在元素周期表中的位置是____;R在自然界中有质量数为35和37的两种核素,它们之间的关系互为 __________________________________________
(2) 根据表中数据推测,Y的原子半径(用r表示)的最小范围是____________。
(3)Y与R相比,非金属性较强的是____(用元素符号表示),下列事实能证明这一结论的是___(选填字母序号)。
A.常温下Y的单质呈固态,R的单质呈气态
B.稳定性XR>YX4
C.Y最高价氧化物对应水化物的酸性弱于R最高价氧化物对应水化物的酸性
(4)用电子式表示X2M___________。
(5) Z的单质与水反应的化学方程式是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com