
某同学对Na2O2和CO2反应后的所得固体进行研究,下列实验方案中不能测得固体中Na2CO3的质量分数的是
A.取a克混合物与足量的稀盐酸充分反应,将反应后的固体加热蒸干、灼烧得到b克固体
B.取a克混合物与足量的稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
C.取a克混合物与足量的BaCl2溶液充分反应,过滤、洗涤、烘干得到b克固体
D.取a克混合物与足量的水反应,加热,使气体完全逸出,冷却至室温测得气体体积为VL(标况)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
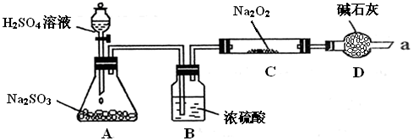

| 实验步骤 | 实验现象 |
| ①取C中固体产物少量于试管中,滴加入过量的稀盐酸 | 产生剌激性气味气体 |
| ②再向上述试管中滴加入适量的BaCl2溶液 | 产生白色沉淀. |
| ③取少量C中固体产物于试管中,加入适量的蒸馏水溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,滴加足量1moL?L-1 H2SO4至固体溶解,然后将内壁附有澄清石灰水的烧杯罩于试管口. | 若澄清石灰水未见浑浊,则假设1成立; 若澄清石灰水变浑浊,则 假设2或假设3成立 假设2或假设3成立 (或假设1不成立) (或假设1不成立) |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.称取
Ⅱ.将Ⅰ中所得溶液分成两等份,一份加入酚酞溶液呈红色,用浓度为4.0 mol·L-1?的盐酸中和,用去该盐酸12.5 mL。将另一份用稀硝酸酸化,无气体产生,再加入过量的Ba(NO3)2溶液,得白色沉淀,质量为
Ⅲ.将Ⅰ中所得的
(1)定性分析:由上述实验现象(不进行数据的计算)可以确定该粉末中一定不含有的是__________;一定含有的是__________。
(2)定量计算:为了进一步确定该粉末中其他成分是否存在,该同学又对有关数据进行了处理,并最终得出混合物的组成和各成分的物质的量,请写出他的计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com