

| A、A-→B+C和B+C-→A两个反应吸收或放出的能量不等 |
| B、A-→B+C是放热反应 |
| C、A具有的能量高于B和C具有的能量总和 |
| D、A-→B+C是吸热反应,则B+C-→A必然是放热反应 |


科目:高中化学 来源: 题型:
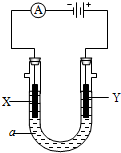 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、《京都议定书》针对六种温室气体进行削减,包括二氧化碳(CO2)、甲烷(CH4)、氧化亚氮(N2O)、氢氟碳化物(HFCs)、全氟碳化物(PFCs)及六氟化硫(SF6).科学研究发现,同条件下等体积的甲烷产生的温室效应远远强于二氧化碳的.那么等质量的二氧化碳产生温室效应比甲烷的强 |
| B、合成高学科王效、稳定、廉价的太阳能光电转化材料,是开发利用太阳能的关键 |
| C、稀土元素都是长周期元素,稀土资源是国家战略性资源 |
| D、环境问题的最终解决要依靠科技进步,通常利用沉淀反应除去污水中的重金属离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+的电子排布式:1s22s22p63s1 |
| B、Fe的简化电子排布式:[Ar]4s2 |
| C、Cr的外围电子排布式:3d54s1 |
D、N的最外层电子排布图: |
查看答案和解析>>
科目:高中化学 来源: 题型:
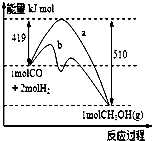 工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g)
工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g)| n(CH3OH) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它们的分子个数比为1:1 |
| B、它们的原子个数比为5:4 |
| C、它们的电子个数比为1:1 |
| D、它们的体积比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体A和B的相对分子质量之比为 a:b |
| B、同质量的气体A和B所含分子数目之比为b:a |
| C、标准状况下,气体A和B的密度之比为b:a |
| D、相同条件下,等体积的气体A和B的质量之比为a:b |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、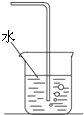 氯气溶于水制氯水 |
B、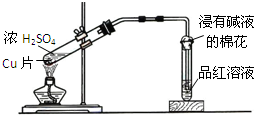 铜与浓硫酸反应 |
C、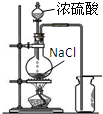 实验室制备并收集氯化氢气体 |
D、 一氧化碳还原氧化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温、高压 |
| 催化剂 |
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com