
原子间形成分子时,决定各原子相互结合的数量关系的是( )
A.共价键的方向性 B.共价键的饱和性
C.共价键原子的大小 D.共价键的稳定性
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )
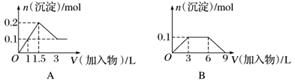
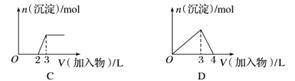
A.向1 L浓度均为0.1 mol·L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol·L-1的稀H2SO4
B.向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液
C.向烧碱溶液中滴加明矾溶液
D.向AlCl3溶液中滴加过量氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
气态氯化铝分子以双聚形式存在,其结构式如图所示:
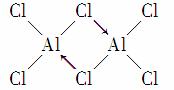
其中Cl→Al表示氯原子提供了一对电子与铝原子共享。又已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它只是一元酸。可以用硼酸在水溶液中的电离平衡解释它只是一元酸的原因,请写出下面这个化学方程式右端的两种离子的表达式:
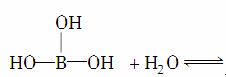 ____________________+________。
____________________+________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在HCl、H2O、NH3、CS2、CH4、N2、BF3分子中:
(1)以非极性键结合的非极性分子是________;
(2)以极性键结合的具有直线形结构的非极性分子是________;
(3)以极性键结合的具有正四面体形结构的非极性分子是________;
(4)以极性键结合的具有三角锥形结构的极性分子是________;
(5)以极性键结合的具有sp3杂化轨道结构的分子是__________________________;
(6)以极性键结合的具有sp2杂化轨道结构的分子的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.σ键比π键重叠程度大,形成的共价键强
B.两个原子之间形成共价键时,最多有一个σ键
C.气体单质中,一定有σ键,可能有π键
D.N2分子中有一个σ键,两个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实与氢键有关的是( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,水存在H2O??H++OH- ΔH>0的平衡,下列叙述一定正确的是( )
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw不变
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸钠,c(H+)=10-7 mol·L-1,Kw不变
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________,直到因加入一滴盐酸后,溶液由黄色变为橙色,并________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________(填字母序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
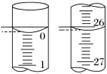
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为______mL,终点读数为______mL,所用盐酸溶液的体积为______mL。
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:N2(g)+2O2(g)===N2O4(g) ΔH=+8.7 kJ/mol,N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534.0 kJ/mol,下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)
ΔH=-542.7 kJ/mol
B.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)
ΔH=-1 059.3 kJ/mol
C.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)
ΔH=-1 076.7 kJ/mol
D.N2H4(g)+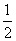 N2O4(g)===
N2O4(g)===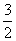 N2(g)+2H2O(g)
N2(g)+2H2O(g)
ΔH=-1 076.7 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com