
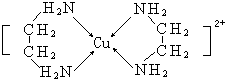
分析 (1)同周期自左而右电负性增大,非金属性越强电负性越大;
(2)乙二胺中N原子形成3个σ键,含有1对孤对电子,杂化轨道数目为4;分子间存在氢键的沸点较高;
(3)Cu2+离子与N原子之间形成配位键,乙二胺中含有极性键、非极性键;
(4)根据 中含有的氨基、乙基来命名;铜离子形成4个配位键.
中含有的氨基、乙基来命名;铜离子形成4个配位键.
解答 解:(1)同周期自左而右电负性增大,非金属性越强电负性越大,H、N、O三种元素的电负性由大到小的顺序是:O>N>H,
故答案为:O>N>H;
(2)乙二胺中N原子形成3个σ键,含有1对孤对电子,杂化轨道数目为4,N原子采取sp3杂化;
乙二胺分子间存在氢键,含有分子间氢键的沸点较高,所以乙二胺沸点高于Cl-CH2CH2-Cl;
故答案为:sp3;前者分子间存在氢键;
(3)Cu2+离子与N原子之间形成配位键,乙二胺中N原子与H原子之间、N原子与C原子之间形成极性键,碳原子之间形成非极性键,所以存在配位键、极性键、非极性;
故答案为:a、b、c;
(4)已知 中含有的氨基、乙基,铜离子为+2价,则配合物[Cu(en)2]Cl2的系统命名为氯化二乙二胺合铜(II);由图可知铜离子形成4个配位键;
中含有的氨基、乙基,铜离子为+2价,则配合物[Cu(en)2]Cl2的系统命名为氯化二乙二胺合铜(II);由图可知铜离子形成4个配位键;
故答案为:氯化二乙二胺合铜(II);4.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电负性、化学键、杂化方式与空间构型判断等,是对学生综合能力的考查,难度中等.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2OH+CuO $\stackrel{△}{→}$ CH3CH2CHO+H2O+Cu | |
| B. | CH3-C≡CH+HCl $\stackrel{催化剂}{→}$ CH3CCl=CH2 | |
| C. | CH3CH2CH2Cl+NaOH $→_{△}^{醇}$ CH3CH=CH2+NaCl+H2O | |
| D. | CH3CH2CH2Cl+NaOH$\stackrel{△}{→}$ CH3CH2CH2OH+NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca:1s22s22p63s23p63d2 | B. | Cu:3d94s2 | ||
| C. | Fe:3d64s2 | D. | C:1s22s12p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
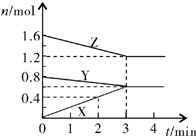 某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 烧杯中盛有NaHSO4和Na2SO4混合溶液体积为100mL,向烧杯中逐滴加入0.15mol•L-1Ba(OH)2溶液,当沉淀量达到最大值时,溶液的总体积为200mL.溶液中产生沉淀的物质的量n与溶液的pH的变化如图所示.请回答:
烧杯中盛有NaHSO4和Na2SO4混合溶液体积为100mL,向烧杯中逐滴加入0.15mol•L-1Ba(OH)2溶液,当沉淀量达到最大值时,溶液的总体积为200mL.溶液中产生沉淀的物质的量n与溶液的pH的变化如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸氢钠溶液与氢氧化钡溶液恰好反应呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| B. | 向石灰水中加入过量小办打溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| C. | 向Ca(ClO)2中通放少量CO2:2ClO -+CO2+H2O=2HClO+CO32- | |
| D. | 用稀硝酸除去试管内壁的银镜:Ag+NO3-+2H+=Ag++NO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油不能与氢气发生加成反应 | B. | 葡萄糖能发生氧化反应和水解反应 | ||
| C. | 淀粉水解的最终产物是葡萄糖 | D. | 蛋白质遇浓硫酸变为黄色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com