
| A、1L0.5mol/L的NaOH溶液 |
| B、2L0.4mol/L的NaNO3溶液 |
| C、3L0.3mol/L的NaCl溶液 |
| D、4L0.2mol/L的Na3PO4溶液 |


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:
| A、往碳酸镁固体中滴加稀盐酸:CO32-+2H+═CO2↑+H2O |
| B、往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
| C、氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
| D、澄清石灰水与过量小苏打溶液混合:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.6 mol/L |
| B、1.4 mol/L |
| C、3.2 mol/L |
| D、1.8 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COOH?H++CH3COO- |
| B、KHSO4?K++H++SO42- |
| C、Al(OH)3?Al3++3OH- |
| D、NaH2PO4?Na++H2PO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸、空气、醋酸、干冰 |
| B、漂白粉、胆矾、氯化钾、硫酸钡 |
| C、蛋白质、油脂、苛性钾、碳酸钙 |
| D、福尔马林、冰醋酸、硫酸钠、乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
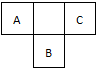 短周期元素的A、B、C,在元素周期表中的位置如图所示,已知A元素单质是空气中含量最多的气体,A、C两种元素的原子核外电子数之和等于B元素的质子数,据此填空:
短周期元素的A、B、C,在元素周期表中的位置如图所示,已知A元素单质是空气中含量最多的气体,A、C两种元素的原子核外电子数之和等于B元素的质子数,据此填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B、提高尾气净化效率的常用方法是升高温度 |
| C、增大压强,上述平衡右移,故可通过增压的方法提高尾气净化效率 |
| D、提高尾气净化效率的最佳途径是使用高效催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com