
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |

分析 (1)反应热=反应物总键能-生成物总键能;根据盖斯定律:反应②-反应①=反应③,反应热也进行相应的计算;
(2)化学平衡常数指可逆反应得到平衡时,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
(3)由图可知,压强一定时,随温度的升高,CO的转化率降低,根据升高温度对反应①、③的影响,进行分析CO转化率变化原因;
相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子式减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大.
解答 解:(1)反应热=反应物总键能-生成物总键能,故△H1=1076kJ.mol-1+2×436kJ.mol-1-(3×413+343+465)kJ.mol-1=-99kJ.mol-1;
根据盖斯定律:反应②-反应①=反应③,故△H3=△H2-△H1=-58kJ.mol-1-(-99kJ.mol-1)=+41kJ.mol-1,
故答案为:-99;+41;
(2)反应①CO(g)+2H2(g)?CH3OH(g)的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$,
反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,曲线a正确反映平衡常数K随温度变化关系,
故答案为:K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;a;
(3)由图可知,压强一定时,随温度的升高,CO的转化率减小,反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小;
相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高,故压强:P3>P2>P1,
故答案为:减小;P3>P2>P1.
点评 本题考查反应热有关计算、平衡常数及其影响因素、化学平衡的影响因素、化学平衡图象综合应用等,侧重考查学生分析计算能力,需要学生具备扎实的基础,难度中等.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
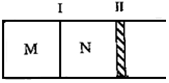 如图所示隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.初始M、N容积相同,保持温度不变,向M、N中分别通入x mol A和y mol B的混合气体.下列说法不正确的是( )
如图所示隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.初始M、N容积相同,保持温度不变,向M、N中分别通入x mol A和y mol B的混合气体.下列说法不正确的是( )| A. | 若平衡时A气体在两容器中的体积分数相等,则x一定等于y | |
| B. | 若x:y=1:2,则平衡时,M中的转化率:A<B | |
| C. | 若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% | |
| D. | 若x=1.4,y=1,N中达到平衡时体积为2L,C为0.4mol,则反应起始时M的体积为2.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 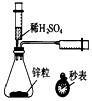 测定一定时间内生成H2的反应速率 | B. |  提取海带中的碘 | ||
| C. | 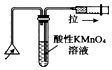 检验火柴燃烧产生的SO2 | D. | 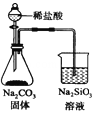 证明非金属性:Cl>C>Si |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com