
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
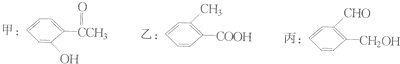
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl-离子的结构示意图: | |
| B. | 中子数为18的氯原子:${\;}_{17}^{35}$Cl | |
| C. | 铁在氯气中燃烧:Fe+Cl2=FeCl2 | |
| D. | 1H、2H、3H、H+、H2是氢元素形成的五种不同粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=1的溶液中:K+、Fe2+、Cl-、NO3- | |
| B. | 滴加酚酞显红色的溶液中:NH4+、Al3+、SO42-、NO3- | |
| C. | 加入铝单质能产生大量氢气的溶液中:Na+、NO3-、SO42-、Cl- | |
| D. | 有大量CO32-存在的无色透明溶液中:Na+、K+、Cl-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.04 mol/L | B. | 0.2 mol/L | C. | 1 mol/L | D. | 2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图中的金属材料R可以用金属锌 | |
| B. | 生铁比软铁芯(几乎是纯铁)容易生铁 | |
| C. | 铁质器附有铜质配件,再接触处易生铁锈 | |
| D. | 金属铝制品较耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液A选用NaOH溶液 | |
| B. | 若溶液B选用浓硝酸,则测得镁的质量分数偏小 | |
| C. | 溶液A和B均可选用稀硝酸 | |
| D. | 实验室中方案Ⅱ更便于实施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A. | ③、④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大 | |
| B. | ②、③两溶液等体积混合,所得溶液中c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 分别加水稀释10倍,四种溶液的pH ①>②>④>③ | |
| D. | VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va:Vb=11:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F2、Cl2、Br2、I2的熔点、沸点逐渐升高 | |
| B. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| C. | Na、Mg、Al的还原性依次减弱 | |
| D. | NaF、NaCl、NaBr、NaI的熔点依次降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com