
| A. | 气态氢化物的稳定性:X<Z | |
| B. | 原子半径:W>Y>Z>X | |
| C. | 最高价氧化物对应水化物的碱性:Y>W | |
| D. | Y、Z的氧化物都有酸性和碱性 |
分析 X、Y、Z、W为周期表中前20号元素中的四种,原子序数依次增大,X原子的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故X为O元素;Y、Z位于同周期,Z单质是一种良好的半导体,则Z为Si;W、Y为金属元素,结合原子序数可知,W为K、Ca中的一种,Y为Na、Mg、Al中的一种,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,则Y、W原子最外层电子数之差为6-4=2,故Y为Al、W为K,据此解答.
解答 解:X、Y、Z、W为周期表中前20号元素中的四种,原子序数依次增大,X原子的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故X为O元素;Y、Z位于同周期,Z单质是一种良好的半导体,则Z为Si;W、Y为金属元素,结合原子序数可知,W为K、Ca中的一种,Y为Na、Mg、Al中的一种,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,则Y、W原子最外层电子数之差为6-4=2,故Y为Al、W为K.
A.X为O,Z为Si,非金属性O>Si,故氢化物稳定性H2O>SiH4,故A错误;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径K>Al>Si>O,故B正确;
C.Y为Al、W为K,金属性K>Al,故碱性KOH>Al(OH)3,故C错误;
D.Y最高价氧化物能为氧化铝,属于两性氧化物,而Z的氧化物为二氧化硅,属于酸性氧化物,故D错误,
故选B.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律的理解掌握.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 三氯化铁溶液中加入铁粉:Fe3++Fe═2Fe2+ | |
| D. | 向Al(OH)3沉淀中滴加盐酸:Al(OH)3+3H+═Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅熔点高硬度大,可用于制作光导纤维 | |
| B. | 氢氧化铝具有弱碱性,可用于胃酸中和剂 | |
| C. | 铁比铜活泼,氯化铁不能用于腐蚀铜板 | |
| D. | 氧化铁能与酸反应,可用于制作红色涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl溶液腐蚀印刷电路板Fe3++Cu═Fe2++Cu2+ | |
| B. | 少量CO2通入澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O | |
| C. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素T、Q、R、W、Z在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素T、Q、R、W、Z在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: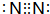
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
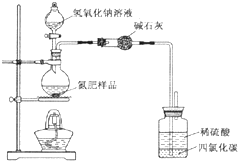 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:| 氢氧化钠溶液体积/mL | 40.00mL | ||
样品质量/g | 7.750 | 15.50 | 23.25 |
氨气质量/g | 1.870 | 1.870 | 1.700 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砂滤是利用过滤原理除去水中较大的固体颗粒 | |
| B. | 臭氧可以消毒杀菌是因为臭氧有强氧化性 | |
| C. | 游泳池水中的臭氧浓度越大越好 | |
| D. | 活性炭可以吸附水中悬浮的杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
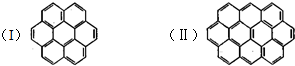 有两个或两个以上的苯环以共有环边的方式相互稠合的多环芳香烃称为稠环芳香烃.下图中椭圆烯也属于稠环芳香烃.据此回答:
有两个或两个以上的苯环以共有环边的方式相互稠合的多环芳香烃称为稠环芳香烃.下图中椭圆烯也属于稠环芳香烃.据此回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com