
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)![]() SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是

A. 反应在c点达到平衡状态B. 反应物的总能量低于生成物的总能量
C. 反应物浓度:a点小于b点D. Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
【答案】D
【解析】
图像题注意先看清楚横纵坐标意义,再结合化学反应速率影响因素和化学平衡影响因素解答此题。
A.化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,c点对应的正反应速率显然还在改变,故一定未达平衡,故A错误;
B.从a到c正反应速率增大,之后正反应速率减小,说明反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,说明该反应为放热反应,即反应物的总能量高于生成物的总能量,故B错误;
C.a到b时正反应速率增加,反应物浓度随时间不断减小,故C错误;
D.随着反应的进行,正反应速率越快,消耗的二氧化硫就越多,SO2的转化率将逐渐增大,故D正确;
答案选D。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuO | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度均为0.1 molL-1 。
阳离子 | K+、Cu2+、Fe3+、Al3+、Fe2+ |
阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
某同学欲探究该废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得溶液中加入BaCl2溶液,有白色沉淀生成。
请回答下列问题:
(1)甲同学最终确定原溶液中所含阳离子有 _____________,阴离子有__________。(写离子符号)
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式为___________________________。
(3)将Ⅲ中红棕色气体(标况下)收集一满试管然后倒扣入水中(假设溶质不扩散),所得溶液中溶质的物质的量浓度为___________ molL-1 (精确到小数点后第三位)。
(4)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体的质量为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,第一步反应生成的沉淀经第二步反应后质量增加的是( )
A.将少量![]() 溶液加入NaOH溶液中,再滴加
溶液加入NaOH溶液中,再滴加![]() 溶液
溶液
B.将少量![]() 溶液滴加到NaCl溶液中,再滴加
溶液滴加到NaCl溶液中,再滴加![]() 溶液
溶液
C.将少量![]() 通入饱和
通入饱和![]() 溶液中,再通入过量
溶液中,再通入过量![]()
D.将少量![]() 溶液滴加到
溶液滴加到![]() 溶液中,再加入过量NaOH溶液
溶液中,再加入过量NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应N2+3H2![]() 2NH3 △H<0达平衡,当单独改变下述条件后有关叙述一定错误的是
2NH3 △H<0达平衡,当单独改变下述条件后有关叙述一定错误的是
A. 加催化剂,v(正)和v(逆)都发生变化,且变化的倍数相等
B. 增加c(N2)瞬间,v(正)和v(逆)都增大,且v(正)增加倍数大于v(逆)增加倍数
C. 降温,v(正)和v(逆)都减少,且v(正)减少倍数小于v(逆)减少倍数
D. 加压,v(正)和v(逆)都增大,且v(正)增加倍数大于v(逆)增加倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组为探究![]() 在酸性
在酸性![]() 溶液中的反应,利用如图装置进行实验:
溶液中的反应,利用如图装置进行实验:
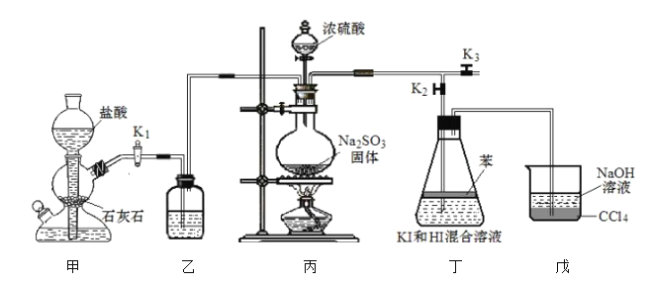
I.排出装置内的空气。减缓![]() 的流速,向丁装置中通入
的流速,向丁装置中通入![]() 和
和![]() 的混合气体。
的混合气体。
Ⅱ.一段时间后,溶液变黄并出现浑浊。摇动锥形瓶、静置,苯与溶液边缘呈紫红色。
Ⅲ.持续向丁装置中通入![]() 和
和![]() 混合气体,溶液变为无色。
混合气体,溶液变为无色。
Ⅳ.再静置一段时间,取锥形瓶中水溶液,滴加![]() 溶液,产生白色沉淀。
溶液,产生白色沉淀。
回答下列问题:
(1)苯的作用为__________。排出装置内空气的具体操作为_________。
(2)向装置丁中缓慢通入![]() 的作用是__________。
的作用是__________。
(3)步骤Ⅱ反应的离子方程式为__________;步骤Ⅲ反应的离子方程式为______________。
(4)实验的总反应为_________,![]() 和
和![]() 在反应中的作用为___________。
在反应中的作用为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知1克氢气燃烧生成液态水时放出143kJ热量,请回答下列问题:
①请写出此反应的热反应方程式 _____,该反应的生成物能量总和__(填“大于”、“小于”或“等于”)反应物能量总和。
②若2mol氢气完全燃烧生成水蒸气,则放出的热量_____(填“>”、“<”或“=”)572 kJ。
③与化石燃料相比,请写出一条氢气作为燃料的优点____
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应的热化学方程式是 _____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“信阳毛尖”是一种绿茶,绿茶中含有的单宁酸(化学式为C76XnO46)具有抑制血压上升、清热解毒等功效。回答下列问题:
(1)已知单宁酸完全燃烧时得到CO2、H2O,则X代表______元素,单宁酸的摩尔质量是1700g·L-1,则n=______,170g单宁酸完全燃烧时可得到______gH2O。
(2)若170g单宁酸某次燃烧时生成了3.6molCO2,则生成的CO最多______g,此种情况下恢复到常温,所得混合气体的平均摩尔质量为______(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是核电荷数依次增大的六种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置为___________________________。
(2)元素C与元素D以原子个数比为1∶1形成化合物Q,请写出Q的电子式为_______。
(3)用电子式表示化合物D2C的形成过程_____________________。
(4)元素A、B、C以原子个数比为4∶2∶3形成化合物W,化合物W中存在的化学键有____________________。
(5)写出碳单质与E的最高价氧化物对应水化物浓溶液反应的化学方程式为____________,当转移电子为0.2 mol时,标准状况下反应产生气体_______________L。
(6)已知E单质和F单质的水溶液反应会生成两种强酸,其离子方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com