
 利用化学反应原理研究氮和硫的化合物有重要意义.
利用化学反应原理研究氮和硫的化合物有重要意义.分析 (1)反应在恒容绝热密闭容器中进行,反应达到平衡状态正逆反应速率相同,各成分含量不变;
(2)根据Ka表达式结合电离平衡常数进行计算;当Qc=Ksp(MnS)时开始沉淀,由此求出硫离子的浓度,结合此时的pH,以及Ksp=c(Mn2+)•c(S2-)进行计算;
(3)①2NO(g)?N2O2(g);②N2O2(g)+O2(g)?2NO2(g),而目标反应2NO(g)+O2(g)?2NO2(g)的△H=①+②,平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{2})c({O}_{2})}$,由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,而正反应是放热反应,所以升高温度,平衡常数减小;
②因为决定2NO(g)+O2(g)?2NO2(g)速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2;决定反应速率的是反应②,而温度越高k2正增大,反应速率加快,二氧化二氮的浓度减少,导致两者的积减小;v2正升高到某一温度时v2正减小,平衡逆向移动,氧气的浓度增大,由此分析解答.
解答 解:(1)反应在恒容绝热密闭容器中进行,反应达到平衡状态正逆反应速率相同,各成分含量不变;
A.2v(S2)=v(H2S),未体现正与逆的关系,故错误;
B.容器内H2S浓度与H2浓度相等,并不是不变,所以不能说明达平衡状态,故错误;
C.平衡常数K不再随时间而变化,说明体系的温度一定,则达平衡状态,故正确;
D.混合气体的密度保持一直不随时间的变化而变化,故错误;
E.混合气体的平均相对分子质量不随时间而变化,说明气体的物质的量不变,反应达平衡状态,故正确;
故答案为:CE;
(2)已知:H2S电离常数:K1=1.3×10-7,25°C时,0.1mol.L-1H2S溶液中,设氢离子浓度是x,根据H2S?H++HS-,则:$\frac{{x}^{2}}{0.1}$=1.3×10-7,解得x=$\sqrt{1.3}$×10-4,当Qc=Ksp(MnS)时开始沉淀,调节溶液的pH=5,H2S电离常数:K2=7.0×10-15,当HS-浓度为1.14×10-4mol•L-1时,c(S2-)=7.98×10-14mol•L-1,
所以Ksp=c(Mn2+)•c(S2-)=7.98×10-14mol•L-1×0.020mol.L-1=2.8×10-13,
故答案为:4;2.8×10-13;
(3)①2NO(g)?N2O2(g);②N2O2(g)+O2(g)?2NO2(g),而目标反应2NO(g)+O2(g)?2NO2(g)的△H=①+②=△H1+△H2,由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)×k2逆c2(NO2),则是K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{2})c({O}_{2})}$=$\frac{{K}_{1正}{K}_{2正}}{{K}_{1逆}{K}_{2逆}}$,而正反应是放热反应,所以升高温度,平衡常数减小,
故答案为:△H1+△H2;$\frac{{K}_{1正}{K}_{2正}}{{K}_{1逆}{K}_{2逆}}$;减小;
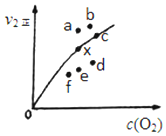
②因为决定2NO(g)+O2(g)?2NO2(g)速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2;决定反应速率的是反应②,而温度越高k2正增大,反应速率加快,二氧化二氮的浓度减少,导致两者的积减小;v2正升高到某一温度时v2正减小,平衡逆向移动,氧气的浓度增大,所以反应重新达到平衡,则变为相应的点为a,
故答案为:<;C;a.
点评 本题考查了盖斯定律的应用、化学平衡的影响因素溶度积常数计算,题目综合性较强,题目难度中等,侧重于考查学生的分析能力、以及对基础知识的综合应用能力.


科目:高中化学 来源: 题型:推断题
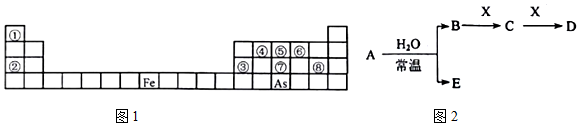
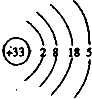 ;其氢化物的化学式为AsH3.
;其氢化物的化学式为AsH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{mω}{28V}$mol•L-1 | B. | $\frac{mω}{56V}$ mol•L-1 | C. | $\frac{mω}{112V}$mol•L-1 | D. | $\frac{mω}{V}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 除杂质所用试剂和方法 | |
| A | KCl溶液 | I2 | CCl4,萃取分液 |
| B | CO2 | HCl | 饱和NaHCO3溶液,洗气 |
| C | Mg粉 | Al粉 | NaOH溶液,过滤 |
| D | CaCO3 | CaO | 盐酸,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
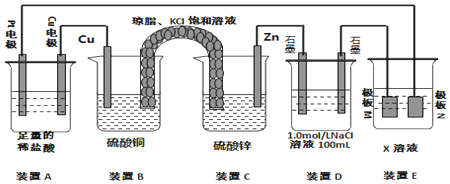
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
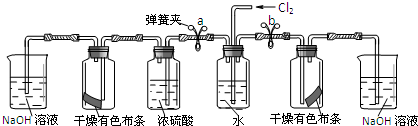
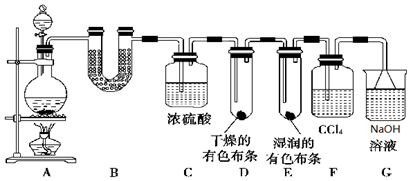
| 步骤 | 实验操作 | 预期现象和结论 |
| ① | 松开a处弹簧夹,夹上b处弹簧夹 | 装置左边集气瓶中的有色布条不褪色 删去,证明猜想一不正确. |
| ② | 松开b处弹簧夹,夹上a处弹簧夹 | 装置右边集气瓶中的有色布条褪色, 说明猜想二正确. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com