
科目:高中化学 来源: 题型:阅读理解

| 物理性质 | 乙酸 | 乙醇 | 1-丁醇 | 乙酸乙酯 | 乙酸丁酯 |
| 熔点(℃) | 16.6 | -117.3 | -89.5 | -83.6 | -73.5 |
| 沸点(℃) | 117.9 | 78.5 | 117 | 77.06 | 126.3 |
| 密度(g/cm3) | 1.05 | 0.79 | 0.81 | 0.90 | 0.88 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
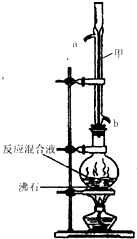 (2012?闸北区二模)苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:
(2012?闸北区二模)苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g?cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2能分别与H2O、CO2反应,可用作供氧剂 | B、Na2CO3的水溶液呈碱性,医学上能用作治疗胃酸过多 | C、硅胶多孔、吸水能力强,常用作袋装食品的干燥剂 | D、铝是活泼的金属单质,铝可用于冶炼某些熔点较高的金属 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省高三第一次月考化学试卷(解析版) 题型:填空题
(10分)决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
578 |
1817 |
2745 |
11578 |
|
B |
738 |
1451 |
7733 |
10540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300 nm的紫外光的光子,光子的能量与光的频率的关系为E=hv,式中h=6.63×10-34J·s,光的波长 与光的频率v的关系为
与光的频率v的关系为 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: 。(未说明原因不给分)
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: 。(未说明原因不给分)
|
共价键 |
C—C |
C—N |
C—S |
|
键能/kJ·mol-1 |
347 |
305 |
259 |
(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似。下表是3种离子晶体的晶格能数据:
|
离子晶体 |
NaCl |
KCl |
CaO |
|
晶格能/kJ·mol-1 |
786 |
715 |
3401 |
离子键的强弱可以用离子晶体的晶格能来衡量,KCl、CaO、TiN 3种离子晶体熔点从高到低的顺序是 。MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5)某配合物的分子结构如图所示,其分子内不含有 (填字母)。

A.离子键 B.共价键 C.配位键 D.氢键
查看答案和解析>>
科目:高中化学 来源:2012届福建省福州八县(市高二下学期期中联考化学试卷 题型:选择题
下列有关物质的熔点的比较中,不正确的是
A. 晶体Si < 金刚石 B.CO2 < SiO2
C. NaCl < NaBr D . PH3 < NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com