
某化学兴趣小组要完成中和热的测定。(已知t1 为NaOH和HCl起始温度平均值,t2 为终止温度。弱电解质电离是吸热的)
| 实 验 用 品 | 溶 液 温 度 | 中和热 △H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol·L-1NaOH | 50mL.0.5mol·L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol·L-1NaOH | 50mL.0.5mol·L-1HCl | 20℃ | 23.5℃ |
(1)实验桌上备有烧杯(大.小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、温度计、
0.5mol· L-1 盐酸、0.55mol· L-1NaOH溶液,实验尚缺少的玻璃用品是 、 。
(2)他们记录的实验数据在表格中。 已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各溶液的密度均为1g·cm-3。请根据实验结果(计算中和热结果保留一位小数)写出NaOH溶液与HCl溶液反应的热化学方程式:
(3)该小组所测得中和热与57.3kJ·mol-1有偏差,产生偏差的原因可能是( )
A、实验装置保温隔热效果差
B、量取NaOH溶液的体积时俯视读数
C、NaOH溶液分几次倒入盐酸中
D、用温度计测定NaOH溶液起始温度后,将温度计洗净擦干再测定盐酸溶液的温度
(4) 实验中若用50mL0.5mol· L-1 醋酸代替HCl溶液(其他操作不变),则测得的中和热会有偏差,其原因是 。
科目:高中化学 来源: 题型:
能源的开发和利用是当前科学研究的重要课题。
(1)利用二氧化铈(CeO2)在太阳能作用下前实现如下变废为宝的过程:
mCeO2 (m-x)CeO2
(m-x)CeO2 xCe+xO2
xCe+xO2
(m-x)CeO2 xCe+xH2O+xCO2
xCe+xH2O+xCO2 mCeO2+xH2+xCO
mCeO2+xH2+xCO
上述过程的总反应是 ,该反应将太阳能转化为 。
(2)CO、O2和KOH溶液构成的燃料电池的负极电极反应式为 。该电池反应可获得K2CO3溶液,某温度下0.5mol L-1。晦K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O
L-1。晦K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O HCO3-+OH-的平衡常熟Kh= 。
HCO3-+OH-的平衡常熟Kh= 。
(3)氯碱工业是高耗能产业,下列将电解池与燃料电池相组合的工艺可以节能30%以上。
①电解过程中发生反应的离子方程式是 ,阴极附近溶液PH (填“不变”、“升高”或“下降”)。
②如果粗盐中SO42-含量较高,精制过程需添加钡试剂除去SO42-,该钡试剂可选用下列试剂中的 。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
现代工艺中更多使用BaCO3除SO42-,请写出发生反应的离子方程式 。
③图中氢氧化钠溶液的质量分数a% b%(填“>”、‘‘=”或“<”),,燃料电池中负极上发生的电极反应为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某微粒的结构示意图为  , 试回答:
, 试回答:
(1)当 时,该微粒为 (填“原子”、“阳离子”或“阴离子”)。
时,该微粒为 (填“原子”、“阳离子”或“阴离子”)。
(2) 时,某中性原子对应的单质分子式为 。
时,某中性原子对应的单质分子式为 。
(3)写出金属铜与 的中性原子的元素最高价氧化物对应水化物浓溶液发生反应的化学方程式 。
的中性原子的元素最高价氧化物对应水化物浓溶液发生反应的化学方程式 。
(4) 的负一价离子电子式为 ,用电子式表示该元素与氢组成化合物的形成过程 。
的负一价离子电子式为 ,用电子式表示该元素与氢组成化合物的形成过程 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关元素周期表、元素周期律的说法中正确的是
①所有元素的最高化合价都等于元素原子的最外层电子数
②最外层一个电子的元素一定是金属元素,肯定在元素周期表的第IA族
③ⅡA族中无非金属元素
④第3周期元素随原子序数增大各非金属元素对应的氧化物的水化物酸性一定逐渐增强
⑤同主族元素随原子序数增大,其原子半径逐渐增大
⑥ 副族元素中没有非金属元素,元素周期表中金属元素的种类比非金属元素多
A. ①②③④⑤⑥ B. ①②③⑥ C.③④⑤ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ.且1 mol 氧气分子中的化学键完全断裂时吸收热量496 kJ,水蒸气中1 mol H―O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A. 920 kJ B. 557 kJ C. 436 kJ D. 188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
某饱和一元醛发生银镜反应时可以析出21.6g银,等量的醛完全燃烧可以产
生6.72LCO2(标况),则该醛为 ( )
A.乙醛 B.2-甲基丙醛 C.丙醛 D.丁醛
查看答案和解析>>
科目:高中化学 来源: 题型:
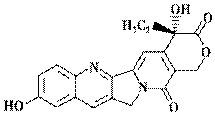
具有显著抗癌活性的10羟基喜树碱的结构如图所示。
下列关于10羟基喜树碱的说法正确的是
A. 分子式为C20H16N2O5
B. 不能与FeCl3溶液发生显色反应
C. 不能发生酯化反应
D. 一定条件下,1 mol该物质最多可与1 mol NaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com