
科目:高中化学 来源:不详 题型:实验题
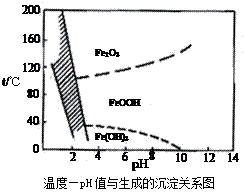
 等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:
等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下: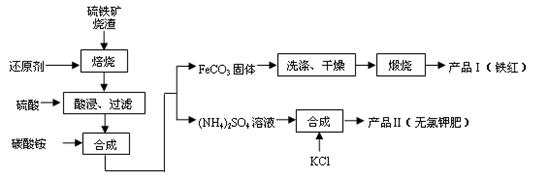
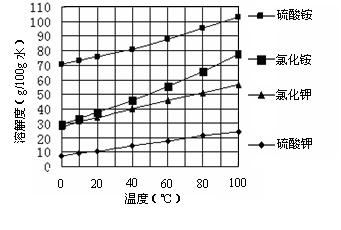
 液。判断Ba(NO3)2已过量的方法是 。
液。判断Ba(NO3)2已过量的方法是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

 器示意图在方框内画出乙烯的发生装置(夹持装置不必画出,需要加热的仪器下方用△标出)。
器示意图在方框内画出乙烯的发生装置(夹持装置不必画出,需要加热的仪器下方用△标出)。 会产生黑烟,实验时若要迅速熄灭火焰,最简单、安全的操作方法是: 。
会产生黑烟,实验时若要迅速熄灭火焰,最简单、安全的操作方法是: 。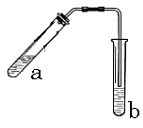
 出实验室制乙酸乙酯的化学方程式(要标出氧-18示踪原子)
出实验室制乙酸乙酯的化学方程式(要标出氧-18示踪原子)查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
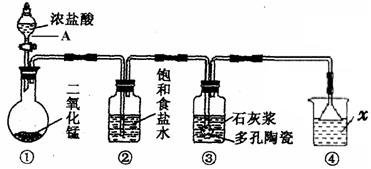
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
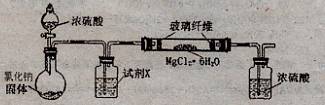
 后,过滤;
后,过滤;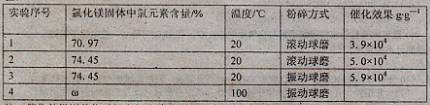
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com