
分析 ①碳酸是二元弱酸,所以碳酸根离子分两步水解,第一步碳酸根离子水解生成碳酸氢根离子,第二步碳酸氢根离子水解生成碳酸根离子;
②发生相互促进水解反应,生成氢氧化铝沉淀和二氧化碳气体;
③碘化银溶解度大于硫化银,二者反应发生沉淀转化生成硫化银.
解答 解:①碳酸是二元弱酸,所以碳酸根离子分两步水解,第一步碳酸根离子水解生成碳酸氢根离子,第二步碳酸氢根离子水解生成碳酸根离子,所以其水解方程式分别为:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-;
故答案为:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-;
②硫酸铝溶液与碳酸氢钠溶液混合,相互促进水解生成沉淀和气体,则反应的离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
③碘化银沉淀加入饱和硫化钠溶液反应的离子方程式为:2AgI(s)+S2-(aq)?Ag2S(s)+2I-(aq),
故答案为:2AgI(s)+S2-(aq)?Ag2S(s)+2I-(aq).
点评 本题考查了盐类水解、沉淀转化等离子方程式书写,注意反应原理和产物的判断,掌握基础是解题关键,题目较简单.


科目:高中化学 来源: 题型:解答题
 .
.时间/h 熔出率 温度 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 |
| 950℃ | 0.669 | 0.711 | 0.713 | 0.714 | 0.714 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10s-15sC(NH3)增加量等于0.25 mol/L | |
| B. | 化学反应速率的关系是3v正(H2)=2v正(NH3) | |
| C. | 达到平衡后,分离出少量NH3,平衡正向移动,v正增大 | |
| D. | 保持压强不变充入Ar气体,v正减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
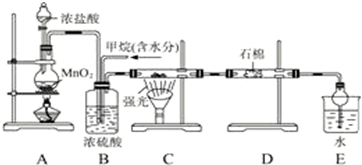
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
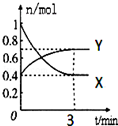 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com