
| A. | SO2气体通入石蕊试液中,溶液先变红后褪色 | |
| B. | 在KI-淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应 | |
| C. | 标准状况下,22.4 L任何气体中都含有6.02×1023个分子 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
分析 A.二氧化硫具有漂白性,但不能漂白酸碱指示剂;
B.氯气具有强氧化性,能氧化碘离子生成碘,碘遇淀粉试液变蓝色;
C.标况下,气体摩尔体积是22.4L/mol,22.4L任何气体的物质的量都是1mol,根据N=nNA确定分子数;
D.浓硝酸不稳定,易分解生成二氧化氮.
解答 解:A.二氧化硫和水反应生成亚硫酸,亚硫酸电离出氢离子而导致溶液呈酸性,紫色石蕊试液遇酸变红色,二氧化硫具有漂白性,但不能漂白酸碱指示剂,所以不褪色,故A错误;
B.氯气具有强氧化性,能氧化碘离子生成碘,碘遇淀粉试液变蓝色,所以在KI-淀粉溶液中通入氯气,溶液变蓝,是因为淀粉遇碘变蓝色,故B错误;
C.标况下,气体摩尔体积是22.4L/mol,22.4L任何气体的物质的量都是1mol,根据N=nNA知分子数为6.02×1023,故C正确;
D.浓硝酸不稳定,易分解生成二氧化氮,浓硝酸中溶解红棕色气体二氧化氮而导致浓硝酸呈现黄色,故D正确;
故选AB.
点评 本题考查元素化合物知识,涉及硝酸的性质、氯气的性质、二氧化硫的漂白性等知识点,明确元素化合物性质是解本题关键,易错选项是A,注意二氧化硫能漂白品红溶液但不能漂白酸碱指示剂,为易错点.


科目:高中化学 来源: 题型:解答题
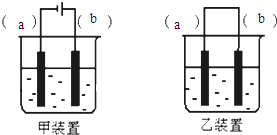 实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀.有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象.请完成以下空白:
实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀.有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象.请完成以下空白:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  可用于NaCl与NH4Cl混合物的分离 | |
| B. |  用于去除Fe(OH)3胶体中含有的可溶性物质 | |
| C. |  橡皮管起到平衡气压、使液体顺利流下的作用 | |
| D. |  若该仪器为酸式滴定管,则表示其内液体体积为5.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
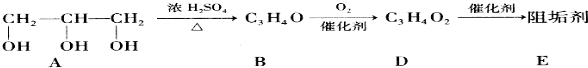
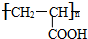 ;其反应类型为加聚反应;
;其反应类型为加聚反应;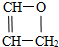 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2L HF气体分解成1L H2和1L F2吸收270KJ热量 | |
| B. | 1mol H2与1mol F2反应生成2mol液态HF放出的热量小于270KJ | |
| C. | 在相同条件下1mol H2与1mol F2的能量总和大于2mol HF气体的能 | |
| D. | 1个氢分子与1个氟分子反应生成2个氟化氢分子放出279KJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液跟少量的饱和石灰水反应2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 向氢氧化钠溶液中加入稀醋酸 OH-+H+═H2O | |
| C. | 向氯化铁溶液中加入铁粉 Fe+FeCl3=2Fe2++3Cl- | |
| D. | Ca(ClO)2溶液中通入过量的二氧化硫气体Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com