
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体 1 120 mL(标准状况),向反应后的溶液中加入1.0 mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是 ( )
A.该合金中铜与镁的物质的量之比是2∶1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
答案 D
解析 分析清楚反应过程,充分利用守恒思想来解决问题。A项向反应后溶液中加入NaOH,生成Mg(OH)2和Cu(OH)2沉淀,固体质量增加的是OH-的质量,且有n(OH-)=n(e-),设合金中镁、铜的物质的量分别为x、y,则有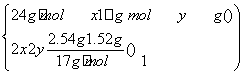
解之得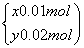 ,则该合金中铜、镁的物质的量之比为2∶1。B项该硝酸的浓度c=
,则该合金中铜、镁的物质的量之比为2∶1。B项该硝酸的浓度c=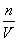 =
= =14.0 mol·L-1。C项NO2和N2O4都来自硝酸,设混合气体中NO2的物质的量为x,根据电子守恒得x+(0.05 mol-x)×2=0.06 mol,x=0.04 mol,NO2的体积分数为80%。D项得到2.54 g沉淀后,溶液中的溶质只有NaNO3,故n(NaOH)=0.7 mol-0.04 mol-0.02 mol=0.64 mol,则NaOH溶液的体积是640 mL。
=14.0 mol·L-1。C项NO2和N2O4都来自硝酸,设混合气体中NO2的物质的量为x,根据电子守恒得x+(0.05 mol-x)×2=0.06 mol,x=0.04 mol,NO2的体积分数为80%。D项得到2.54 g沉淀后,溶液中的溶质只有NaNO3,故n(NaOH)=0.7 mol-0.04 mol-0.02 mol=0.64 mol,则NaOH溶液的体积是640 mL。


科目:高中化学 来源: 题型:
据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是( )

A.电池放电时Na+从a极区移向b极区
B.每消耗3 mol H2O2,转移的电子为3 mol
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.该电池的负极反应为BH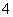 +2H2O-8e-===BO
+2H2O-8e-===BO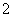 +8H+
+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求写出下列反应的离子方程式:
(1)在NH4Cl溶液中加入NaOH溶液,并加热
________________________________________________________________________。
(2)在NH4Cl溶液中滴加NaOH溶液
________________________________________________________________________。
(3)NH4Cl溶液呈酸性的原因
_____________________ ___________________________________________________。
___________________________________________________。
(4)在饱和NH4Cl溶液中滴加Na[Al(OH)4],产生刺激性气味的气体和白色沉淀
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室模拟合成氨和氨催化氧化的流程如下:
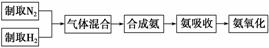
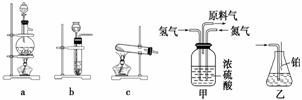
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从图中选择制取气体的合适装置:氮气__________________________________、
氢气______________。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有________、 ________________________________。
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,________ (“会”或“不 会”)发生倒吸,原因是___________________________________________________
(“会”或“不 会”)发生倒吸,原因是___________________________________________________
________________________________________________________________________。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是____________________________ _______________,
_______________,
锥形瓶中还可观察到的现象是_____________________________________________。
(5)写出乙装置中氨氧化的化学方程式:_____________________________________
____________________。
(6)反应结束后锥形瓶内的溶液中含有的离子为H+、OH-、________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推断正确的是 ( )
A.N2、NO、NO2都是大气污染气体,在空气中都能稳定存在
B.向AlCl3溶液中滴加过量的氨水能看到先产生白色沉淀,后沉淀溶解
C.可用浓硫酸或者浓硝酸除去镀在铝表面的铜镀层
D.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
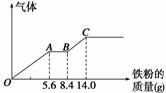 某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。
向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是 ( )
A.原混合酸中NO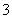 物质的量为0.1 mol
物质的量为0.1 mol
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+===3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4浓度为2.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况)。向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是21
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)在标准状况下,1 mol O2与1 mol SO3的体积相同 ( )
(2)在标准状况下,1 mol气体的体积约是22.4 L,在非标准状况下,1 mol气体的体积则一定不是22.4 L ( )
(3)在相同条件下,相同物质的量的CO、N2的混合气体与O2的分子个数相同,原子个数也相同 ( )
(4)若把(3)中的O2改成氩气,判断结果是 ( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com