
����Ŀ��д�����з�Ӧ���Ȼ�ѧ����ʽ��
��1��16 g CH4(g)������O2(g)��Ӧ����CO2(g)��H2O(l)���ų�890.3 kJ���� ��
��2��1 L 1 mol��L1 KOH��Һ�к�1 L 1 mol��L1 HNO3��Һ���ų�57.3 kJ���� ��
��3��12 g C(s)������O2(g)��Ӧ����CO2(g)���ų�393��5 kJ���� ��
��4���������������Ӧ������1 mol�⻯������ʱ������25��59 kJ���� ��
��5��1 mol������[C6H12O6(s)]����������ȫ����������CO2(g)��H2O(l)����2 800 kJ���� ��
���𰸡���1��CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) ��H=890.3 kJ��mol1��2�֣�
CO2(g)+2H2O(l) ��H=890.3 kJ��mol1��2�֣�
��2��KOH(aq)+HNO3(aq)![]() KNO3(aq)+H2O(l) ��H=57.3 kJ��mol1��2�֣�
KNO3(aq)+H2O(l) ��H=57.3 kJ��mol1��2�֣�
��3��C(s)+O2(g)![]() CO2(g) ��H=393.5 kJ��mol1��2�֣�
CO2(g) ��H=393.5 kJ��mol1��2�֣�
��4��H2(g)+I2(g)![]() 2HI(g) ��H=+51.18 kJ��mol1��2�֣�
2HI(g) ��H=+51.18 kJ��mol1��2�֣�
��5��C6H12O6(s)+6O2(g)![]() 6CO2(g)+6H2O(l) ��H=2 800 kJ��mol1��2�֣�
6CO2(g)+6H2O(l) ��H=2 800 kJ��mol1��2�֣�
����������


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������п���õ������Ӳ�������ͭ��Һ�У����������0.4 mol����ͨ��ʱ�������������仯��
A������6.5g B.����5.6g C.����11.2g D.����13g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. �������������������ά B. �������������Ư��ֽ��
C. ʯ��ʯ����ʯ�෨������ȼú���� D. Ũ�������ǿ�����ԣ����ܸ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ũ��Ϊ0.1mol/L=HF��Һ��ˮ����ϡ�ͣ����и���ʼ�ձ����������
A. c(H+) B. Ka(HF) C. ![]() D.
D. ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC4H8Cl2���л��������ֻ����һ�����Ľṹ��(�����������칹)�� ��
A.4��B.5��C.6��D.7��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����������������Ƚ������ⷽ������������������������������Ӧ��ϵ��ͬʱͨ����顢������ˮ��������������Ҫ��ѧ��Ӧ����
��ѧ����ʽ | �ʱ� ��H/(kJ��mol1) | |
���� ���� | CH4(g)+2O2(g) | ��H1 |
CH4(g)+O2(g) | 322.0 | |
���� ���� | CH4(g)+H2O(g) | 206.2 |
CH4(g)+2H2O(g) | 165.0 |
����ӦCO(g)+H2O(g)![]() CO2(g)+H2(g)�Ħ�H= kJ��mol1��
CO2(g)+H2(g)�Ħ�H= kJ��mol1��
��1 mol������ȫȼ�յķ�Ӧ��Ϊ��H2����H2 (�>����<����=��)��H1��
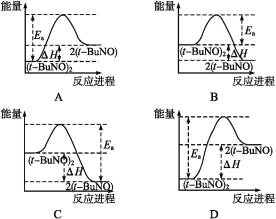
��2������(tBuNO)2���������ܼ��з������·�Ӧ��(tBuNO)2![]() 2(tBuNO) ��H��ʵ���ø÷�Ӧ�Ħ�H=+50.5 kJ��mol1�����Ea=90.4 kJ��mol1������������ϵͼ�������� ��
2(tBuNO) ��H��ʵ���ø÷�Ӧ�Ħ�H=+50.5 kJ��mol1�����Ea=90.4 kJ��mol1������������ϵͼ�������� ��
��3������β������Ҫ����CO��NO2��SO2��CO2��Ŀǰ���õ�������������װ���а�װһ��������������Ч�ؽ�β���е��к�����ת��������CO(g)+NO2(g)![]() NO(g)+ CO2(g) ��H=a kJ��mol1(a>0)
NO(g)+ CO2(g) ��H=a kJ��mol1(a>0)
2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ��H=b kJ��mol1(b>0)
N2(g)+2CO2(g) ��H=b kJ��mol1(b>0)
���ñ�״���µ�3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��MOHǿ����Һ�͵��������Ũ�ȵ�HA������Һ��Ϻ���Һ���й����ӵ�Ũ��Ӧ����Ĺ�ϵ��
A. c(M��)>c(OH��)>c(A��)>c(H��) B. c(M��)>c(A��)>c(H��)>c(OH��)
C. c(M��)>c(A��)>c(OH��)>c(H��) D. c(M��)>c(H��)>c(A��)>c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�������ȷ�Ӧ���ǣ�������
A.�Ҵ���ȼ��B.������������Ƶ��кͷ�Ӧ
C.Ba(OH)2��8H2O��NH4Cl��ӦD.п����ϡH2SO4��Ӧ��ȡH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Na2CO3��NaHCO3�Ƚ��У�����˵������ȷ����
A. NaHCO3�����������ֽ⣬��Na2CO3�������Ȳ����ֽ�
B. ��������Na2CO3��NaHCO3�ֱ������������ᷴӦ��ǰ��������������ʵ����Ⱥ��߶�
C. �����ʵ���Ũ�ȵ�Na2CO3��NaHCO3��Һ�ֱ�μ�2�η�̪��Һ��ǰ����ɫ�Ⱥ�����
D. Na2CO3��Һ��NaHCO3��Һ�ֱ���Ba(OH)2��Һ��Ӧ�����ӷ���ʽ��ͬ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com