
【题目】已知: A、B、C、D、E、F、G 是原子序数依次增大的短周期主族元素,A的原子核内无中子,B、F 在元素周期表中的相对位置如图,B 与D 能形成两种无色气体,D 是地壳中含量最多的元素,E是地壳中含量最多的金属元素;

请回答下列问题:
(1)BF2 的结构式为:_____________;
(2)D和F的简单氢化物中沸点较高的是:________。(填化学式)
(3)实验室制取G2气体的离子方程式为:____________________;
(4)在微电子工业中,C 的最简单气态氛化物的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物 不污染环境,其化学方程式为:___________________;
(5)FD2 气休通入BaCl2 和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体, 有关反应的离子方程式为_____________________;
(6)火箭使用B2A8C2 作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种 无污染的气体,其化学方程式为:_________________;
(7)上述元索可组成盐Q: CA4E(FD4)2。向盛有20 mL 0.5 mol/L Q溶液的烧杯中加入12 mL2.0 mo/LBa(OH)2溶液,充分反应后,溶液中产生沉定的物质的量为:__________。
【答案】 S=C=S H2O MnO2+4H-+2C1-![]() Mn2++Cl2↑+2H2O 2NH3·H2O+3H2O2=N2↑+8H2O 3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO+4H+ C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O↑ 0.022mol
Mn2++Cl2↑+2H2O 2NH3·H2O+3H2O2=N2↑+8H2O 3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO+4H+ C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O↑ 0.022mol
【解析】A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,A的原子核内无中子,则A为氢元素;D是地壳中含量最多的元素,则D是氧,E是地壳中含量最多的金属元素,则E为铝;由B、F在元素周期表中的相对位置及B与氧元素能形成两种无色气体,则B为碳,F为硫,G为氯;即A、B、C、D、E、F、G七种元素分别为H、C、N、O、Al、S、Cl。(1)CS2的结构类似于CO2,其结构式为S=C=S;(2)水分子间存在氢键,H2O常温下是液态,H2S常温下是气态,沸点较高的是H2O;(3)实验室利用二氧化锰和浓盐酸加热反应制取Cl2,发生反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;(4)H2O2氧化一水合氨,得到无污染的气体产物为氮气,同时还原产物为水,所发生反应的化学方程式为2NH3·H2O+3H2O2===N2↑+8H2O;(5)SO2气体通入BaCl2和HNO3混合溶液中,生成白色沉淀BaSO4和无色气体NO,根据电子守恒和电荷守恒及原子守恒可得此反应的离子方程式3SO2+3Ba2++2NO3-+2H2O===3BaSO4↓+2NO↑+4H+;(6)火箭使用C2H8N2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,产生N2、CO2及水,其化学方程式为C2H8N2+2N2O4===2CO2↑+3N2↑+4H2O↑;(7)盐Q是NH4Al(SO4)2,其物质的量为0.01 mol,而Ba(OH)2物质的量为0.024 mol,则n(BaSO4)=0.02 mol,0.01 molAl3+产生0.01 molAl(OH)3,过量的OH-先与铵根反应,用去0.01 mol,还有0.008 molOH-溶解掉0.008 molAl(OH)3,故最终沉淀为0.02 molBaSO4和0.002 molAl(OH)3,共计是0.022mol。
Mn2++Cl2↑+2H2O;(4)H2O2氧化一水合氨,得到无污染的气体产物为氮气,同时还原产物为水,所发生反应的化学方程式为2NH3·H2O+3H2O2===N2↑+8H2O;(5)SO2气体通入BaCl2和HNO3混合溶液中,生成白色沉淀BaSO4和无色气体NO,根据电子守恒和电荷守恒及原子守恒可得此反应的离子方程式3SO2+3Ba2++2NO3-+2H2O===3BaSO4↓+2NO↑+4H+;(6)火箭使用C2H8N2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,产生N2、CO2及水,其化学方程式为C2H8N2+2N2O4===2CO2↑+3N2↑+4H2O↑;(7)盐Q是NH4Al(SO4)2,其物质的量为0.01 mol,而Ba(OH)2物质的量为0.024 mol,则n(BaSO4)=0.02 mol,0.01 molAl3+产生0.01 molAl(OH)3,过量的OH-先与铵根反应,用去0.01 mol,还有0.008 molOH-溶解掉0.008 molAl(OH)3,故最终沉淀为0.02 molBaSO4和0.002 molAl(OH)3,共计是0.022mol。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图,则下列离子组在对应的溶液中一定能大量共存的是( )
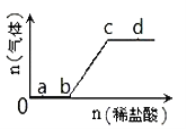
A. a点对应的溶液中:Ca2+、Mg2+、Br—、NO3—
B. b点对应的溶液中:Na+、OH—、Cl—、NO3—
C. c点对应的溶液中:Na+、Ca2+、NO3—、Cl—
D. d点对应的溶液中:F—、NO3—、Fe2+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验(A为电流计):

观察到现象:
装置图1:Cu电极上产生大量的无色气泡
装置图2:Cu电极上无气泡产生,而Cr电极上产生大量气泡
则下列说法正确的是
A. 图1是电解池,图2是原电池
B. 两个电池中,电子均由Cr电极流向Cu电极
C. 图2中Cr电极可能被浓HNO3钝化成惰性电极
D. 由实验现象可知金属活动性:Cu>Cr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数表化如下图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强. 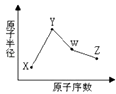
(1)W位于元素周期表中第周期第族.画出X的阴离子的结构示意图 .
(2)Z的氢化物和溴化氢相比,较稳定的是(写化学式);Z的氢化物与氟化氢相比,沸点较高的是(写化学式).
(3)Y的金属性与Mg的金属性相比,(写化学式)的金属性强,请用实验证明它们金属性的相对强弱: .
(4)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物发生反应的化学反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲酸乙酯的反应装置示意图和有关数据如下:
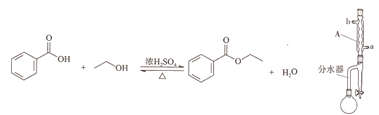
相对分子质量 | 密度/(g/cm3) | 沸点/℃ | 水中溶解性 | |
苯甲酸 | 122 | 1.266 | 249 | 微溶 |
乙醇 | 46 | 0.789 | 78.3 | 溶 |
苯甲酸乙酯 | 150 | 1.045 | 213 | 难溶 |
环己烷 | 84 | 0.779 | 80.8 | 难溶 |
环已烷、乙醇和水可形成共沸物,其混合物沸点为62.1℃。
合成反应:向圆底烧瓶中加入6.1g苯甲酸、20mL无水乙醇、25mL环已烷和2片碎瓷片,搅拌后再加入2mL浓硫酸。按图组装好仪器后,水裕加热回流1.5小时。
分离提纯:继续水浴加热蒸出多余乙醇和环已烷,经分水器放出。剩余物质倒入盛有60mL冷水的烧怀中,依次用碳酸钠、无水氯化钙处理后,再蒸馏纯化,收集210~213℃的馏分。得产品5.0g。
回答下列问题:
(1)仪器A的名称为_______,冷却水应从______(填“a”或“b”)口流出。
(2)加入环己烷的目的为______________。
(3)合成反应中,分水器中会出现分层现象,且下层液体逐渐增多,当下层液体高度超过距分水器支管约2cm时开启活塞放出少量下层波体。该操作的目的为_________________。
(4)实验中加入碳酸钠的目的为__________;经碳酸钠处理后,若粗产品与水分层不清,可采取的措施为___________(填字母)。
(5)在该实验中,圆底烧瓶的容积最适合的是_____。
A.50mL B.100mL C.200mL D.300mL
(6)本实验的产率为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曾因可能致癌而陷舆论风波的除草剂一一草甘膦已于2017 年11月被相关部门正式批准可继续使用,其结构如图所示,下列说法不正确的是

A. 1mol 的草甘膦可以与3mol 的NaOH中和
B. 分子式为C3H8NO5P
C. 可以溶于水
D. 属于酯类的同分异构体只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005 年,法拉利公司发布的敞篷车(法拉利Superamerica),其玻璃车顶采用了先进的电致变色技术,即在原来玻璃材料基础上增加了有电致变色系统组成五层中膜材料(如下图所示)。其工作原理是: 在外接电源(外加电场) 下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节,下列有关说法不正确的是
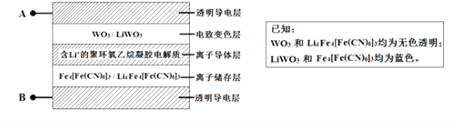
A. 当A接外接电源负极时,电致变色层发生反应为: WO3+Li++e-= LiWO3
B. 当A接外接电源正极时,Li+脱离离子存储层
C. 该电致变色系统在较长时间的使用过程中,离子导体层中Li+的量可保持基本不变
D. 当B接外接电源正极时,膜的透射率降低,可以有效阻挡阳光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将KOH溶液滴加到己二酸(H2X) 溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
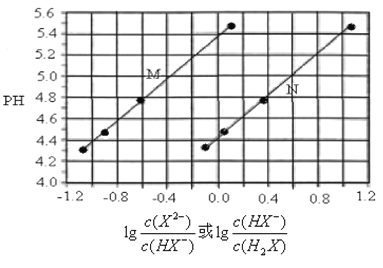
A. Ka2(H2X)的数量级为10–4
B. KHX溶液中c(H+)>c(OH-)
C. 曲线N表示pH与1g[c(X2-)/c(HX-)]的变化关系
D. 当混合溶液呈中性时,c(K+) >c(HX-) > c(X2-) > c(OH-) =c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中进行反应A(g)2B(g)+C(g),若A的浓度由0.1molL﹣1降到0.06molL﹣1需20s,那么由0.06molL﹣1降到0.024molL﹣1 , 需要时间可能是( )
A.18s
B.12s
C.30s
D.10s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com