
| A. | OH- | B. | NH4+ | C. | H3O+ | D. | CH4 |
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 用明矾净水 | 明矾具有杀菌消毒的作用 |
| B | 局部地区出现酸雨 | 煤、石油的燃烧产生大量CO2 |
| C | 潮湿环境中的铁制品生锈 | 铁制品中的Fe与空气中的O2直接反应生成Fe2O3 |
| D | “84”消毒液具有漂白性 | “84”消毒液中的NaClO与空气中的CO2反应生成HClO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨工厂采用增大压强以提高原料的转化率 | |
| B. | 实验室用排饱和食盐水法收集氯气 | |
| C. | 打开汽水瓶有气泡从溶液中冒出 | |
| D. | 2NO2(g)═N2O4(g)的平衡体系中,加压缩小体积后颜色加深用来表示可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ⅥA 元素的各种性质可归纳整理如下:
ⅥA 元素的各种性质可归纳整理如下:| 性质 | 8O | 16S | 34Se | 52Te |
| 单质熔点/℃ | -218.4 | 113 | 271 | 450 |
| 单质沸点/℃ | -183 | 444.6 | 685 | 1390 |
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
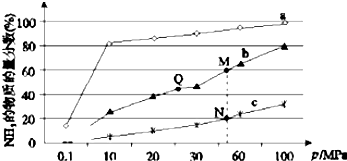
| A. | 上图中M、N、Q点平衡常数K 的大小关系为K(M)=K(Q)>K(N) | |
| B. | 加催化剂能加快反应速率但H2的平衡转化率不变 | |
| C. | 相同压强条件下,投料相同,达到平衡所需时间关系为a>b>c | |
| D. | 由曲线a可知,当压强增加到10OMPa以上,NH3的物质的量分数可达到100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3和H2O化学反应速率关系是2v正(NH3)=3v正(H2O) | |
| B. | 达到化学平衡时,4v正(O2)=5v逆(NO) | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 | |
| D. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于2amol•L-1 | B. | 等于2amol•L-1 | C. | 小于2amol•L-1 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验试剂及用量 | 溶液温度 | |||
| t1 | t2 | |||
| ① | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.3℃ |
| ② | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.5℃ |
| ③ | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 24.5℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com