
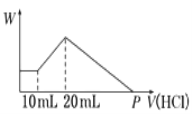
【题目】把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如右图所示:
(1)混合物中NaOH的质量为_________________
(2)混合物中MgCl2的质量为_________________
(3)混合物中AlCl3的物质的量为_________________
(4)P点表示盐酸的体积是_________________
【答案】 1.8g 0.95g 0.005mol 90mL
【解析】试题分析:本题考查与Mg(OH)2、Al(OH)3有关的图像分析和混合物的计算。由图像知,开始加入10mL盐酸,沉淀既不增加也不减少,所以浑浊液中含NaOH;则NaOH、AlCl3、MgCl2的固体混合物溶于水时发生的反应为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+4NaOH=3NaCl+NaAlO2+2H2O;0.58g沉淀为Mg(OH)2。根据Mg守恒,n(MgCl2)=n[Mg(OH)2]= ![]() =0.01mol;根据图像知,加入10mL~20mL盐酸时发生的反应为NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,n(NaAlO2)=n[Al(OH)3]=0.5mol/L
=0.01mol;根据图像知,加入10mL~20mL盐酸时发生的反应为NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,n(NaAlO2)=n[Al(OH)3]=0.5mol/L![]() 0.01L=0.005mol,根据Al守恒,n(AlCl3)=n(NaAlO2)=0.005mol。
0.01L=0.005mol,根据Al守恒,n(AlCl3)=n(NaAlO2)=0.005mol。
(1)当加入20mL盐酸沉淀量达最大,发生的反应为NaOH+HCl=NaCl+H2O、NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,此时溶液中的溶质为NaCl,根据Na、Cl守恒,Na全部来自NaOH,Cl来自MgCl2、AlCl3和加入的20mL的盐酸,混合物中n(NaOH)=2n(MgCl2)+3n(AlCl3)+0.5mol/L![]() 0.02L=2
0.02L=2![]() 0.01mol+3
0.01mol+3![]() 0.005mol+0.01mol=0.045mol,m(NaOH)=0.045mol
0.005mol+0.01mol=0.045mol,m(NaOH)=0.045mol![]() 40g/mol=1.8g。
40g/mol=1.8g。
(2)混合物中m(MgCl2)=0.01mol![]() 95g/mol=0.95g。
95g/mol=0.95g。
(3)混合物中AlCl3物质的量为0.005mol。
(4)沉淀达最大时,沉淀由Mg(OH)2和Al(OH)3组成;溶解Mg(OH)2发生的反应为Mg(OH)2+2HCl=MgCl2+2H2O,溶解Mg(OH)2消耗HCl物质的量为2n[Mg(OH)2]=2![]() 0.01mol=0.02mol;溶解Al(OH)3发生的反应为Al(OH)3+3HCl=AlCl3+3H2O,溶解Al(OH)3消耗HCl物质的量为3n[Al(OH)3]=3
0.01mol=0.02mol;溶解Al(OH)3发生的反应为Al(OH)3+3HCl=AlCl3+3H2O,溶解Al(OH)3消耗HCl物质的量为3n[Al(OH)3]=3![]() 0.005mol=0.015mol;沉淀完全溶解消耗的HCl物质的量为0.02mol+0.015mol=0.035mol,消耗盐酸的体积为0.035mol
0.005mol=0.015mol;沉淀完全溶解消耗的HCl物质的量为0.02mol+0.015mol=0.035mol,消耗盐酸的体积为0.035mol![]() 0.5mol/L=0.07L=70mL,P点表示盐酸的体积为20mL+70mL=90mL。
0.5mol/L=0.07L=70mL,P点表示盐酸的体积为20mL+70mL=90mL。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A.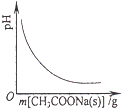 向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.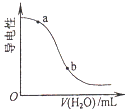 向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C.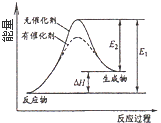 催化剂能改变化学反应的焓变
催化剂能改变化学反应的焓变
D.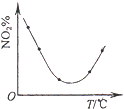 等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见有机反应类型有①加聚②加成 ③氧化 ④酯化或取代 ⑤取代,请用序号填写,甲烷与氯气在光照条件下的反应是_________反应,乙烯与溴水的反应是________反应,乙烯使高锰酸钾溶液褪色的反应是_________反应,乙酸和乙醇在一定条件下制取乙酸乙酯的反应是________反应,乙烯制取聚乙烯的反应是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠主要用于皮革、毛纺、高档纸张、染料等行业.生产硫化钠大多采用无水芒硝(Na2SO4)﹣炭粉还原法,其流程示意图如图1: 
(1)上述流程中“碱浸”后,物质A必须经过(填写操作名称)处理后,方可“煅烧”;若煅烧所得气体为等物质的量的CO和CO2 , 写出煅烧时发生的总的化学反应方程式为 .
(2)上述流程中采用稀碱液比用热水更好,理由是 .
(3)取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌.若反应后测得溶液的pH=4,则此时溶液中c( S2﹣)= . (已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10﹣36、2.2×10﹣20)
(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图2所示).为使除汞效果最佳,应控制的条件是、 . ②某毛纺厂废水中含0.001 molL﹣1的硫化钠,与纸张漂白后的废水(含0.002 molL﹣1 NaClO)按1:2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据英国《自然》杂志报道,科学家最近研制成了以锶原子做钟摆的“光晶格钟”,成了世界上最精确的钟。已知一种锶原子的相对原子质量为88,其质子数是38,则这种锶原子的中子数为
A.38B.50C.88D.126
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用右图所示装置进行NaHCO3的受热分解实验。请回答:

(1)加热一段时间后,烧杯中观察到的实验现象是__________________________
(2)实验结束时的正确操作是____(填字母);
A.先从液体中移出导管,再熄灭酒精灯
B.先熄灭酒精灯,再从液体中移出导管。
否则会引起___________。
(3)NaHCO3受热分解的化学方程式________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料. ①Ti2+基态的外围电子排布式可表示为 .
②BH4﹣的空间构型是(用文字描述).
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2 ![]() 2NH3实现储氢和输氢.下列说法正确的是(多项选择).
2NH3实现储氢和输氢.下列说法正确的是(多项选择).
A.NH3分子中N原子采用sp3杂化
B.相同压强时,NH3沸点比PH3高
C.[Cu(NH3)4]2+离子中,N原子是配位原子
D.CN﹣的电子式为[:C┇┇N:]﹣
(3)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子. ①C60晶体易溶于苯、CS2 , C60是分子(填“极性”或“非极性”).
②1mol C60分子中,含有σ键数目为 .
(4)一种由Mg和H元素组成的物质是金属氢化物储氢材料,其晶胞结构如图2所示,该物质化学式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3 , 不考虑其他杂质)制取绿矾(FeSO47H2O),设计了如下流程,下列说法不正确的是( )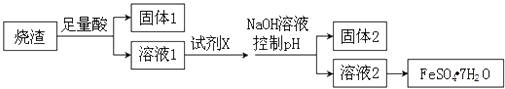
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2 , 控制pH是为了使Al3+转化为Al(OH)3 , 进入固体2
C.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO47H2O
D.从溶液2得到FeSO47H2O产品的过程中,须控制条件防止其氧化和分解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com