
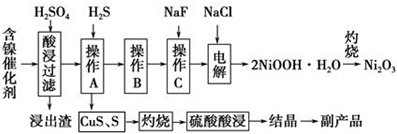
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
分析 废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),用硫酸浸取,过滤得含有镍离子、铁离子、钙离子、铜离子的溶液,再通入硫化氢除去铜离子,且使铁离子被还原成亚铁离子,得硫化铜、硫固体,过滤得滤液中含有镍离子、亚铁离子、钙离子,加入氟化钠除去钙离子,再加入氯化钠后电解得NiOOH,灼烧得三氧化二镍,硫化铜、硫固体灼烧后用硫酸酸浸得硫酸铜溶液,结晶可得硫酸铜晶体,
(1)Fe2O3和硫酸反应生成盐和水,反应方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)氧化钙和氧化钡与硫酸反应生成难溶的硫酸钙和硫酸钡;
(3)用氢氧化钠溶液调节溶液的pH值,容易引入杂质,所以方案是错误的;正确的操作应该是在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+;
(4)CuS、S灼烧后溶于稀硫酸中生成硫酸铜,所以副产品应该是胆矾;根据3Cu~2NO,3Cu2O~2NO,n(Cu)=0.1mol,n(NO)=0.1mol,可得混合物中Cu2O为0.05mol,故CuO为0.05mol.混合物中,0.1mol Cu不与稀H2SO4反应,0.05molCu2O、0.05molCuO与稀H2SO4反应,根据Cu2O、CuO中氧原子与H2SO4反应结合H+生成H2O,据此计算消耗硫酸;
(5)常温时CaF2的溶度积常数为2.7×10-11可知,溶液中F-浓度为3×10-3 mol•L-1,再计算出钙离子的浓度;
(6)①阳极上氯离子失电子生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水,所以阳极反应式为Cl-+2OH--2e-═ClO-+H2O;
②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀,其还原产物是氯离子.
解答 解:(1)Fe2O3和硫酸反应生成盐和水,反应方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,
故答案为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)氧化钙和氧化钡与硫酸反应生成难溶的硫酸钙和硫酸钡,所以浸出渣主要成分为CaSO4•2H2O和BaSO4,
故答案为:BaSO4;
(3)由于用氢氧化钠溶液调节溶液的pH值,容易引入杂质,所以方案是错误的;正确的操作应该是在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+,
故答案为:方案错误,在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+;
(4)由于CuS、S灼烧后溶于稀硫酸中生成硫酸铜,所以副产品应该是胆矾,即CuSO4•5H2O,
根据3Cu~2NO可知,0.1molCu反应生成NO为$\frac{0.2}{3}$mol,故3Cu2O~2NO反应生成NO为($\frac{2.24L}{22.4L/mol}$-$\frac{0.2}{3}$mol),可得混合物中Cu2O为(0.1mol-$\frac{0.2}{3}$mol)×$\frac{3}{2}$=0.05mol,故CuO为0.25mol-0.1mol-0.05mol=0.05mol,混合物中,0.1mol Cu不与稀H2SO4反应,0.05molCu2O、0.05molCuO与稀H2SO4反应,根据Cu2O、CuO中氧原子与H2SO4反应结合H+生成H2O,可得n(H2SO4)=0.05mol+0.05mol=0.1mol,
故答案为:CuSO4•5H2O;0.1;
(5)根据常温时CaF2的溶度积常数为2.7×10-11可知,溶液中F-浓度为3×10-3 mol•L-1,则Ca2+的浓度为$\frac{2.7×10{\;}^{-11}}{(3×10{\;}^{-3}){\;}^{2}}$=3×10-6 mol/L,所以则溶液中$\frac{c(Ca{\;}^{2+})}{c(F{\;}^{-})}$=$\frac{3×10{\;}^{-6}}{3×10{\;}^{-3}}$=1.0×10-3,
故答案为:1.0×10-3;
(6)①阳极上氯离子失电子生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水,所以阳极反应式为Cl-+2OH--2e-═ClO-+H2O,故答案为:Cl-+2OH--2e-=ClO-+H2O;
②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀,其还原产物是氯离子,则根据电子的得失守恒可知,反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-,
故答案为:ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.
点评 该题以废旧含镍催化剂生产NiO为载体,重点考查学生对工艺流程试题了解掌握情况,侧重考查学生的逻辑推理能力和规范严谨的实验设计能力以及动手操作能力,该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.2mol•L-1•min-1 | B. | v(NO2)=0.2mol•L-1•min-1 | ||
| C. | v(H2O)=0.005mol•L-1•s-1 | D. | v(N2)=0.005mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入KSCN溶液(或硫氰化钾溶液) | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 固体中含有FeO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com