
| A. | 标准状况下,11.2 L NO与11.2 L O2混合后所含分子数为0.75NA | |
| B. | pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 0.1 mol Na2O2晶体中含有0.3NA个离子 | |
| D. | 标准状况下,22.4L甲醇中含有的氧原子数为1.0NA |
分析 A、11.2LNO与11.2LO2混合后发生的反应为2NO+O2═2NO2,2NO2 N2O4,则反应后的气体的物质的量小于0.75mol;
N2O4,则反应后的气体的物质的量小于0.75mol;
B、依据体积和氢氧根离子浓度计算物质的量;
C、Na2O2中含2molNa+和1molO22-;
D、标况下,甲醇为液态.
解答 解:A、11.2LNO与11.2LO2混合后发生的反应为2NO+O2═2NO2,2NO2 N2O4,则反应后的气体的物质的量小于0.75mol,混合后所含分子数目小于0.75NA,故A错误;
N2O4,则反应后的气体的物质的量小于0.75mol,混合后所含分子数目小于0.75NA,故A错误;
B、pH=13的1.0LBa(OH)2溶液中,水也能电离出氢氧根离子,所以含有的OH-数目大于0.2NA,故B错误;
C、Na2O2中含2molNa+和1molO22-,故1molNa2O2中含3mol离子,即3NA个,故C正确;
D、标况下,甲醇为液态,不能根据气体摩尔体积来计算其物质的量,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 新制氯水中加入固体NaOH:c(Na+)=c(C1-)+c(ClO- )+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(OH+)>c( H2CO3) | |
| C. | pH=ll的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.2 mol•L-l CH3COOH溶液与0.1 mol•L-l NaOH溶液等体积混合:2c(H+)-2c(OH-)=C(CH3COO-)-c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①⑤ | C. | ①④⑤ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO${\;}_{3}^{2-}$ | B. | HCO${\;}_{3}^{-}$ | C. | CH3COO- | D. | SO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
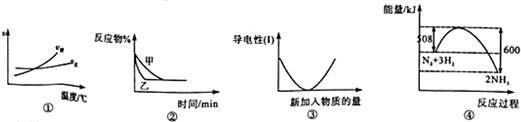
| A. | 根据图①可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H>0 | |
| B. | 图②可以表示压强对可逆反应“2A(g)+2B(g)?3C(g)+D(s)”的影响,乙的压强大 | |
| C. | 图③可表示硫酸溶液中滴加氢氧化钡溶液至过量过程中溶液导电性的变化 | |
| D. | 图④是N2与H2合成氨的能量变化曲线,可确定该反应,1molN2和3molH2充分反应时放热一定等于92kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14 g乙烯和环丙烷的混合物中总原子数为3NA | |
| B. | 标准状况下,2.24L苯中约含有0.6NA个碳原子 | |
| C. | 4.6 g乙醇中含有的C-H键的个数为0.6NA | |
| D. | 1 mol  分子中含碳碳双键数为3NA 分子中含碳碳双键数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 实验室制取乙烯气体时,将温度计的水银球放入液面以下 | |
| B. | 向淀粉水解后的溶液中加入碘水,溶液变蓝,证明淀粉尚未水解 | |
| C. | 证明分子CH2=CH-CHO既含有醛基又含有C=C,可先向溶液中先加入足量的银氨溶液加热,充分反应后,再加入足量的溴水 | |
| D. | 在蔗糖与稀硫酸共热后的溶液中,滴加银氨溶液,验证产物中的葡萄糖 | |
| E. | 用新制的银氨溶液可区分甲酸甲酯和乙醛 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com