
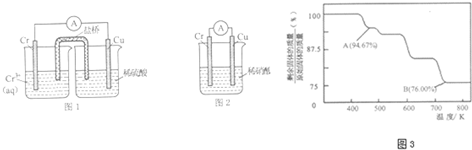
分析 (1)图1装置铜电极上产生大量的无色气泡,说明Cr的活泼性大于Cu,能和稀硫酸反应生成H2;而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,说明Cr和硝酸能产生钝化现象;
(2)根据化合价升降总数相等以及原子守恒来解答;
(3)①根据质量守恒定律,在变化过程中,Cr的质量没有变,求出氧原子和铬原子的个数比即可;
②先求出B的固体的成分,再利用原子守恒写出方程式;
(4)①NaCl为电解质,加入适量的NaCl可增强溶液的导电能力;
②先根据KspFe(OH)3和c(Fe3+)求出c(OH-),然后再根据c(OH-)和KspCr(OH)3求出c(Cr3+).
解答 解:(1)图1装置铜电极上产生大量的无色气泡,说明Cr的活泼性大于Cu,能和稀硫酸反应生成 H2;而图 2装置中铜电极上无气体产生,铬电极上产生大量有色气体,说明Cr和硝酸能产生钝化现象,
故答案为:金属铬的活动性比铜强,能和稀硫酸反应生成 H2;金属铬易被稀硝酸钝化;
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,乙醇被氧化成乙酸,碳的平均化合价从-2价升高到0,1个乙醇化合价变化4,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],铬的化合价从+6价降低到+3价,1个CrO3化合价变化3,两者的最小公倍数是12,再根据原子守恒得4CrO3+3CH3CH2OH+12H+═4Cr3++3CH3COOH+9H2O,
故答案为:4CrO3+3CH3CH2OH+12H+═4Cr3++3CH3COOH+9H2O;
(3)①设CrO3的质量为100g,则CrO3中铬元素的质量为:100g×$\frac{52}{52+16×3}$=52g,A点时固体的质量为:100g×94.67%=94.67g,Co的质量没有变,所以生成物中Co的质量为52g,氧元素的质量为42.67g,两者的个数比为$\frac{52}{52}$:$\frac{42.67}{16}$=3:8,所以A点时剩余固体的成分是Cr3O8,故答案为:Cr3O8;
②B点时固体的质量为:100g×76%=76g,Cr的质量没有变,所以生成物中Cr的质量为52g,氧元素的质量为16,两者的个数比为$\frac{52}{52}$:$\frac{24}{16}$=2:3,所以B点时剩余固体的成分是Cr2O3,所以加热到 750K 时成分是Cr2O3,则反应方程式为:4CrO3$\frac{\underline{\;加热\;}}{\;}$2Cr2O3+3O2↑,
故答案为:4CrO3$\frac{\underline{\;加热\;}}{\;}$2Cr2O3+3O2↑;
(4)①因NaCl为电解质,加入适量的NaCl可增强溶液的导电能力,故答案为:增强溶液的导电能力;
②溶液中c(OH-)=$\root{3}{\frac{{K}_{sp}[Fe(OH)_{3}]}{c(F{e}^{3+})}}$=$\root{3}{\frac{4.0×1{0}^{-38}}{2.0×1{0}^{-13}}}$mol/L=$\root{3}{2.0×1{0}^{-25}}$mol/L,则溶液中c(Cr3+)=$\frac{{K}_{sp}[Cr(OH)_{3}]}{{c}^{3}(O{H}^{-})}$=$\frac{6.0×1{0}^{-31}}{2.0×1{0}^{-25}}$=3.0×10ˉ6mol/L,
故答案为:3.0×10ˉ6.
点评 本题考查了原电池、电解池的工作原理,以及氧化还原反应、Ksp的有关计算,以及图象分析,题目难度中等,注意对图象的分析和数据的处理.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g O2占有的体积约为22.4L | |
| B. | 22.4LN2含有NA个氮气分子 | |
| C. | 在标准状况下,22.4L水的质量约为18g | |
| D. | 11g二氧化碳与标准状况下5.6L HCl含有相同的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | |
| B. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | |
| C. | 2C2H5OH→C2H5-O-C2H5+H2O | |
| D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
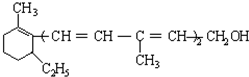
| A. | 维生素A是一种烯烃 | |
| B. | 维生素A的一个分子中有30个氢原子 | |
| C. | 维生素A的一个分子中有三个双键 | |
| D. | 维生素A能使溴水褪色,能被酸性KMnO4氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为都是多糖,所以都具有甜味 | |
| B. | 因为具有相同的分子式(C6H10O5)n,所以互为同分异构体 | |
| C. | 两者都能水解生成葡萄糖 | |
| D. | 淀粉不是天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+ K+ OH- Cl- | B. | Na+ Cu2+ SO42- NO3- | ||
| C. | K+ Na+ SO42- Cl- | D. | Ba2+ CO32- NO3- K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| B. | 25℃时pH=10的NaOH溶液与pH=10的氨水中:c(Na+)=c(NH4+) | |
| C. | 25℃时pH=9、浓度均为0.1mol/L的NH3•H2O、NH4Cl混合溶液:c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| D. | 0.1mol/L(NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com