
【题目】下列是某学生自己总结的一些规律,其中正确的是( )
A.氧化物不可能是分解反应的产物
B.有些化学反应不属于化合、分解、置换、复分解中的任何一种反应
C.根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
D.饱和溶液一定比不饱和溶液的浓度大
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)直接燃料电池具有启动快、效率高等优点,用二甲醚燃料电池电解甲基肼(CH3—NH—NH2)制氢的装置如图所示,其中X、Y、M、N均为惰性电极。下列说法正确的是( )
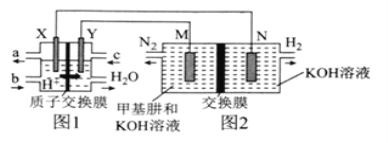
A.M极的电极反应式为CH3—NH—NH2+12OH--10e-=CO![]() +N2↑+9H2O
+N2↑+9H2O
B.图1中电解质溶液的pH减小,图2中电解质溶液的pH增大
C.图2中的交换膜是阴离子交换膜,OH-透过交换膜向N极移动
D.理论上,当生成6.72LH2时,消耗CH3OCH3的质量为2.3g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①用50mL 0.50mol/L盐酸与50mL一定浓度的NaOH溶液在如图所示的装置中进行中和反应。
通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称__,另一处错误是____。
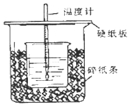
②实验室提供了0.50mol/L和0.55mol/L两种浓度的NaOH溶液,应该选择___molL-1的溶液进行实验。大烧杯上如不盖硬纸板,求得的中和热数值____(填“偏大、偏小、无影响”)。
③如果用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会____;(填“偏大、偏小、无影响”)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L的NaOH溶液所求中和热____(填“相等、不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
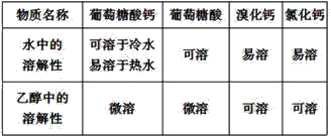
实验流程如下:
C6H12O6(aq)![]()
![]()
![]()
![]() 悬浊液
悬浊液![]()
![]()
![]() (C6H11O7)2Ca
(C6H11O7)2Ca
请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,下列装置最适合的是__。
A.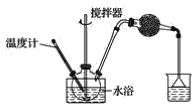
B.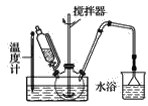
C.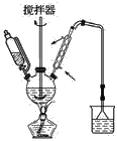
(2)制备葡萄糖酸钙的过程中,葡萄糖氧化也可用其它试剂,下列物质中最适合的是__。
A.新制氢氧化铜悬浊液
B.酸性高锰酸钾溶液
C.氧气/葡萄糖氧化酶
D.银氨溶液
(3)第②步充分反应后碳酸钙固体需有剩余,其目的是__。
(4)第②步实验中不用氯化钙替代碳酸钙的理由是__。
(5)第③步需趁热过滤的原因是__。
(6)第④步加入乙醇的作用是__。
(7)第⑥步中,下列洗涤剂最合适的是__。
A.冷水 B.热水
C.乙醇 D.乙醇-水混合溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(7分)某含有一个双键的气态烯烃和另一气态烷烃的混合气体,在同温同压下其密度是H2的13.2倍。在标准状况下将4.48L混合气体通过足量的溴水,结果溴水增重3.36g,求原混合气体中各烃的体积分数。 (注:此题必须写出过程,否则不得分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b. CO(g)+H2O(g)CO2(g)+H2(g) H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)CO2(g)+4H2(g) H= _____________。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
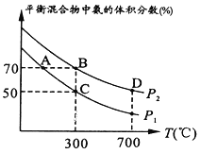
①恒压时,反应一定达到平衡状态的标志是_____________(填序号)
A.![]() 和
和![]() 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变
C.![]() 保持不变 D.
保持不变 D.![]()
②P1_____P2 (填“<”或“>”或“=”或“不确定”,下同);反应的平衡常数:B点_______D点。
③C点![]() 的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水中的电离方程式书写正确的是( )
A.H2CO3![]() 2H++CO32-B.Al(OH)3=Al3+ +3OH-
2H++CO32-B.Al(OH)3=Al3+ +3OH-
C.NH3·H2O![]() NH4+ +OH-D.NaHSO4=Na++HSO4-
NH4+ +OH-D.NaHSO4=Na++HSO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以锈蚀程度很大的废铁屑为原料制备FeCl3·6H2O晶体的流程可简要表示如下:
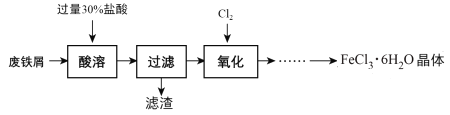
已知:在水溶液中Fe2+能与K3Fe(CN)6生成蓝色沉淀Fe3[Fe(CN)6]2。
试回答下列问题:
(1)“酸溶”过程中发生主要反应有:
①Fe +2H+=Fe2++H2↑;②Fe2O3+ 6H+=2Fe3++3H2O;③___。(用离子方程式表示)
(2)“酸溶”需控制温度在40℃左右,最佳的加热方式是____。
(3)“过滤”需要的玻璃仪器除烧杯外还有___。
(4)“氧化”过程可在如图所示装置中进行。

①装置A中KMnO4与浓盐酸反应生成MnCl2和Cl2,其离子方程式为___。
②装置C的作用是____。
③为使Cl2能充分发生反应,除在B中使用多孔球泡和搅拌外,实验中可采取的措施是___。
④证明装置B溶液中Fe2+已完全被氧化成Fe3+的实验方案是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应N2O4(g)![]() 2NO2(g);△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g);△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是

A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. 由状态B到状态A,可以用加热的方法
D. B、C两点NO2的体积分数相同,所以平衡常数也相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com