
【题目】氢能将成为21世纪的主要能源。太阳能光伏电池电解水可制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。

(1)制H2时,连接________(填“K1”或“K2”),产生H2的电极反应式是____________,溶液pH___________(填“增大”、“减小”或“不变”)。
(2)改变开关连接方式,可得O2,此时电极3的反应式为:__________________。
【答案】K1 2H2O+2e-=H2↑+2OH- 增大 NiOOH+H2O+e-=Ni(OH)2+OH-
【解析】
电解水生成氢气和氧气,氧气在阳极生成,氢气在阴极生成,则制H2时,应连接K1,电极1为阴极,电极反应式为2H2O+2e-=H2↑+2OH-,电极3为阳极,电极反应式为Ni(OH)2-e-+OH-=NiOOH+H2O;制O2时,连接K2,电极2为阳极,电极反应式为4OH--4e-=O2↑+2H2O,电极3为阴极,电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,从而实现NiOOHNi(OH)2的转化,且可循环使用。
(1)电解水生成氢气和氧气,氧气在阳极生成,氢气在阴极生成,则制H2时,应连接K1,电极反应式为2H2O+2e-=H2↑+2OH-,溶液pH增大;
故答案为:K1;2H2O+2e-=H2↑+2OH-;增大;
(2)制O2时,连接K2,电极3为阴极,发生反应NiOOH+H2O+e-=Ni(OH)2+OH-,从而实现NiOOHNi(OH)2的转化,且可循环使用;
故答案为:NiOOH+H2O+e-=Ni(OH)2+OH-。


科目:高中化学 来源: 题型:
【题目】某同学用中和滴定法测定某烧碱的纯度,实验过程如下:
(1) 配制待测液:称取6.0 g固体烧碱样品(杂质不与酸反应)配制成250 mL溶液。
(2) 滴定:
①用_______量取15.00 ml.待测液。
②向锥形瓶中加入几滴甲基橙,用0.2010 mol L-1的标准硫酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,滴定终点时的现象为________________。
(3)数据处理
实验次 序编号 | 硫酸溶液体积 V/mL | 氢氧化钠溶液体积 V/mL |
1 | 19.90 | 15.00 |
2 | 20.10 | 15.00 |
3 | 22.00 | 15.00 |
4 | 20.00 | 15.00 |
根据上述表格,选取合适的数据,计算待测烧碱溶液的浓度为______________,碱的纯度为_______________(保留两位小数)。
(4)—定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制盐酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是
__________________(多选)
A.实验中所用到的滴定管、容量瓶,在使用前均需要验漏
B.如果实验中需用80 mL的稀盐酸标准溶液,配制时应选用100mL容量瓶
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀盐酸,则测得的NaOH溶液的浓度将偏小
E.配制标准溶液时,定容时俯视读数,则导致滴定时测得的NaOH溶液的浓度偏大
F.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏小
G.锥形瓶用蒸馏水洗浄后,有少量蒸馏水残留,则导致实验结果偏小
H.滴定前滴定管尖嘴有气泡,滴定后气泡消失,则导致实验结果偏大
I.在滴定过程中,不慎将数滴酸液滴在锥形瓶外,则导致实验结果偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置可以模拟铁的电化学腐蚀。下列说法中,正确的是
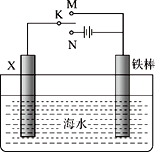
A. 若X为碳棒,开关K置于M处可以减缓铁的腐蚀
B. 若X为铜棒,开关K置于N处可以加快铁的腐蚀
C. 若X为碳棒,开关K置于M处,则为牺牲阳极的阴极保护法
D. 若X为碳棒,开关K置于N处,则为外加电流的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是( )

A.b是阳离子交换膜,允许Na+通过
B.从A口出来的是NaOH溶液
C.阴极反应式为4OH--4e-= 2H2O+O2↑
D.Na2SO4溶液从G口加入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出![]() 中官能团的名称为_________________;
中官能团的名称为_________________;
(2)![]() 的分子式为_____________,1 mol该有机物完全燃烧需消耗氧气的物质的量为________mol,分子中一定共面的原子有________个;
的分子式为_____________,1 mol该有机物完全燃烧需消耗氧气的物质的量为________mol,分子中一定共面的原子有________个;
(3)有机物M(![]() )为苯的同分异构体,M的二氯代物的同分异构体有____种;
)为苯的同分异构体,M的二氯代物的同分异构体有____种;
(4)用系统命名法对下列有机物进行命名:
① CH3C(CH3)=CHCH3:______________;
② CH3CH(CH2CH3)CH(CH3)CH2CH3:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述中正确的是( )

A. 根据图甲可知合成甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(g) △H1=(b-a)kJ·mol-1
B. 图乙表示2mol H2(g)所具有的能量比2mol气态水所具有的能量多483.6kJ
C. 1mol NaOH分别和1mol CH3COOH、1mol HNO3反应,后者比前者△H小
D. 汽油燃烧时将全部的化学能转化为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1[
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,
则CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3kJ·mol-1
D.500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是
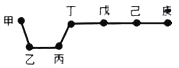
A.简单气态氢化物的稳定性:庚>己>戊>丁
B.单质甲与单质乙充分反应一定都可以生成多种化合物
C.可以通过分别电解熔融的金属氯化物的方法冶炼乙和丙的单质
D.因为庚元素的非金属性最强,所以庚的最高价氧化物对应水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向2L恒容容器中充入1molA和1molB,发生反应A(g)+B(g)=C(g)经过一段时间后达到平衡,反应过程中测定的部分数据如表。下对说法正确的是( )
t/s | 0 | 5 | 15 | 25 | 35 | ||
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 | ||
A. 前 5 s 的平均反应速率v(A)=0.03 mol·L-1·s-1
B. 正反应是吸热反应
C. 保持温度不变,起始时向容器中充入2molC,达平衡时,C的转化率大于80%
D. 保持温度不变,起始时向容器中充入0.2molA、0.2molB和1molC, 反应达到平衡前v(正)<v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com