
| A. | 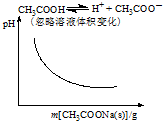 | B. | 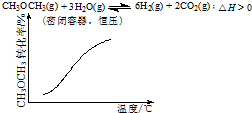 | ||
| C. |  | D. | 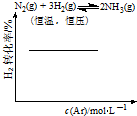 |
分析 根据图象中的纵横坐标表示的意义,分析某条件改变时,一个量随另外一个量的变化,若变化趋势与图中一致,则为正确答案.
A、醋酸溶液中加入醋酸钠,醋酸电离平衡逆向移动;
B、该反应为吸热反应,升温平衡正向移动;
C、KCl对平衡移动无影响;
D、恒压加入Ar,容器体积增大.
解答 解:A、CH3COOH溶液中存在电离平衡,加入醋酸钠固体,电离平衡逆向移动,c(H+)减小,pH逐渐增大,与图中不符合,故A错误;
B、因反应为吸热反应,则压强不变时,升高温度,平衡正向移动,则甲醚的转化率增大,与图中相符合,故B正确;
C、因该反应中K+、Cl-实际不参加反应,则加入KCl对平衡体系无影响,化学平衡不移动,铁离子的浓度不变,与图中不符合,故C错误;
D、恒温恒压,加入Ar,各反应物的物质的量不变,体积变大,各物质的量浓度减小(等效于减压),化学平衡朝体积增大方向移动,反应逆向进行,H2的改变量减小,起始量不变,转化率减小,图中不符合,故D错误;
故选B.
点评 本题考查化学平衡的移动与化学平衡图象,明确影响化学平衡的移动因素是解答本题的关键,并注意图中曲线变化趋势的意义来解答.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:解答题
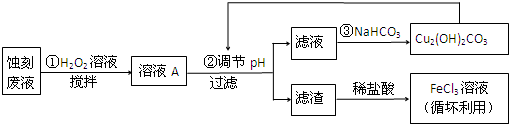
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 分子间作用力比化学键弱得多,但它对物质熔点、沸点有较大影响,而对溶解度无影响 | |
| D. | ${\;}_{\;}^{14}$C可用于文物年代的鉴定,${\;}_{\;}^{14}$C与${\;}_{\;}^{12}$C互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 运用化学反应原理研究部分单质及其化合物的反应有重要意义.
运用化学反应原理研究部分单质及其化合物的反应有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
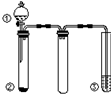 利用如图所示装置进行下列实验,能得出相应实验结论的是( )
利用如图所示装置进行下列实验,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:S>C>Si |
| B | 稀硝酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) |
| C | 浓盐酸 | MnO2 | NaOH溶液 | 氧化性:MnO2>Cl2 |
| D | 浓硫酸 | 蔗糖 | 酸性KMnO4溶液 | 浓硫酸具有酸性、脱水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.8mol/L | D. | 1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸馏水中加入大量NaOH固体,KW不变 | |
| B. | 0.1mol/LHF溶液的PH=2,则该溶液中c(OH-)>c(HF) | |
| C. | 在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V≥$\frac{1}{18}$ | B. | V≤$\frac{1}{23}$ | C. | V<$\frac{1}{18}$ | D. | V≤$\frac{1}{56}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com