
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同 | |
| B. | 乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大 | |
| D. | 除去蛋白质溶液中的NaCl而不改变它的性质,可加入适量的AgNO3溶液,再过滤 |
分析 A、烷烃中含有几种等效氢原子,则一氯代物有几种;
B、葡萄糖中含有羟基,能使高锰酸钾溶液褪色;
C、环己烷是一种密度比水小的无色液体;
D、重金属盐能使蛋白质发生变性.
解答 解:A、2,2-二甲基丁烷中含有3种等效氢原子,则一氯代物有3种,2,4-二甲基戊烷中含有3种等效氢原子,则一氯代物也有3种,故A正确;
B、乙烷和苯不能使高锰酸钾溶液褪色,但是葡萄糖中含有羟基,能使高锰酸钾溶液褪色,故B错误;
C、环己烷是一种密度比水小的无色液体,故C错误;
D、AgNO3是重金属盐能使蛋白质发生变性,变性是不可逆过程,故D错误,故选A.
点评 本题主要考查的是同分异构体的判断、常见有机化合物的性质、皂化反应等,综合性较强,有一定难度.


科目:高中化学 来源: 题型:选择题
| A. | 羟甲基(-CH2OH)和甲氧基(CH3O-) | B. | S2-和Cl- | ||
| C. | Mg2+和F- | D. | 羟基(-OH)和氢氧根(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子发生化学变化时,会生成新的分子,但不会分裂成原子 | |
| B. | 2molH2和1molO2完全反应,结果放出930kJ的热量 | |
| C. | 1molH-H和$\frac{1}{2}$molO-O键的断裂过程共放出930KJ的热量 | |
| D. | 分析变化的全过程,可得出形成H-O键将放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 奥运火炬燃烧主要是将化学能转变为热能和光能 | |
| B. | 丙烷的沸点比正丁烷高 | |
| C. | 丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的负极 | |
| D. | 丙烷与甲烷属同系物,也无同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 298K时,某容积固定为1L的密闭容器中发生如下可逆反应:A(g)?2B(g)△H=akJ•mol-1.其中B的物质的量浓度随时间变化如图所示.试回答下列问题.
298K时,某容积固定为1L的密闭容器中发生如下可逆反应:A(g)?2B(g)△H=akJ•mol-1.其中B的物质的量浓度随时间变化如图所示.试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 溶解度:SO2>CO2 | ||
| C. | 酸性:HClO4>H2SO4 | D. | 气态氢化物的稳定性:H2O>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
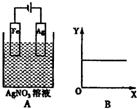
| A. | c (Ag+) | B. | 溶液的pH | C. | Ag棒的质量 | D. | c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
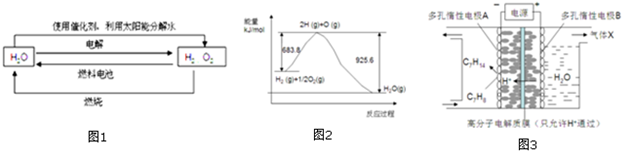
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com