
Ϊ���ܵ�װ�ã��������Һͨ����KOH��Һ�����й��ڼ״�ȼ�ϵ�ص�˵����ȷ����
�ټ״�Ϊ������Ӧ�� �ڸ����ĵ缫��ӦʽΪO2+2H2O+4e-![]() 4OH- �۸����ĵ缫��ӦʽΪCH3OH+8OH--6e-
4OH- �۸����ĵ缫��ӦʽΪCH3OH+8OH--6e-![]()
![]() +6H2O �ܷŵ�ʱ��Һ�е����������ƶ� �ݷŵ�һ��ʱ�����ҺpH���� �ŵ�ʱ�����ͳ��ʱ�����ķ�Ӧ��Ϊ������Ӧ
+6H2O �ܷŵ�ʱ��Һ�е����������ƶ� �ݷŵ�һ��ʱ�����ҺpH���� �ŵ�ʱ�����ͳ��ʱ�����ķ�Ӧ��Ϊ������Ӧ
A.�ۢݢ� B.�ۢܢ� C.�٢ڢ� D.�٢ܢ�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-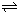 C2D4��g������H��0���ں��º��������£���һ����CD2��C2D4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У���Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ��ͼ��ʾ��
C2D4��g������H��0���ں��º��������£���һ����CD2��C2D4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У���Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ��ͼ��ʾ��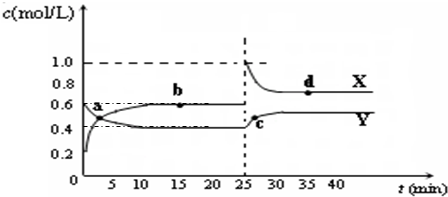
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ���ŷ�ȼ�ϵ������������ʱ������־��Ϊ21���ı����������ʮ���¿Ƽ�֮�ף�������ߴ�����������ӽ���Ĥȼ�ϵ�صĹ���ԭ����ͼ��ʾ�����е缫a��b��Ϊ����Բ��缫������˵���в���ȷ���ǣ�������
���ŷ�ȼ�ϵ������������ʱ������־��Ϊ21���ı����������ʮ���¿Ƽ�֮�ף�������ߴ�����������ӽ���Ĥȼ�ϵ�صĹ���ԭ����ͼ��ʾ�����е缫a��b��Ϊ����Բ��缫������˵���в���ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��1��0.1mol/LNa2CO3��Һ��
��1��0.1mol/LNa2CO3��Һ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
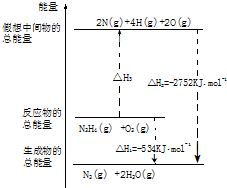 �����£�N2H4���ǵ������ֳ���������ڿ�ѧ����������������Ҫ��Ӧ�ã�
�����£�N2H4���ǵ������ֳ���������ڿ�ѧ����������������Ҫ��Ӧ�ã��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
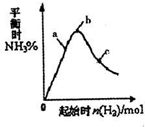 ��ҵ������N2��H2���Ժϳ�NH3��NH3�ֿ��Խ�һ���Ʊ�������N2H4���ȣ�
��ҵ������N2��H2���Ժϳ�NH3��NH3�ֿ��Խ�һ���Ʊ�������N2H4���ȣ�| 1 | 2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com