
【题目】在室温下,向Cu(IO3)2饱和溶液中加入足量的经稀硫酸酸化的KI溶液,产生CuI沉淀,溶液由蓝色变为棕黄色,反应前加入淀粉溶液不变蓝,反应后加入淀粉溶液变为蓝色。
(1)该反应中氧化剂是 ______ ;
(2)该反应的还原产物是 ______ ;
(3)1 mol氧化剂在反应中得到电子的物质的量为 ______ ;
(4)某反应体系中有物质:Bi2(SO4)3、NaMnO4、H2O、MnSO4、NaBiO3、Na2SO4、H2SO4请将NaBiO3之外的反应物与生成物分别填入以下空格内,配平化学计量数,并在氧化剂与还原剂之间标出电子转移的方向和数目。
_________NaBiO3+_____ ________ + _____ ________→_____ _______ + ______ ________+ ______ _______+ ______ _______。
_____________
【答案】Cu(IO3)2 CuI、I2 11 mol 10 4 MnSO4 14 H2SO4 5 Bi2(SO4)3 4 NaMnO4 3 Na2SO4 14 H2O 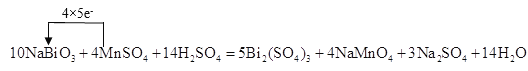
【解析】
(1)~(3)Cu(IO3)2与KI在硫酸酸化条件下反应产生I2,CuI沉淀,同时得到K2SO4、H2O,根据氧化剂得到电子,元素化合价降低,还原剂失去电子,元素化合价升高,元素化合价升降数目等于1 mol物质失去或得到的电子数目;
(4)从NaBiO3是反应物开始分析,另一种含有铋的化合物Bi2(SO4)3是生成物,Bi化合价降低,则反应物NaBiO3作氧化剂,则MnSO4为反应物,NaMnO4为生成物,生成物中的SO42-由H2SO4提供,则H2SO4是反应物,结合元素守恒,生成物中还有Na2SO4、H2O。
(1)向Cu(IO3)2饱和溶液中加入足量的经稀硫酸酸化的KI溶液,产生CuI沉淀,溶液由蓝色变为棕黄色,反应前加入淀粉溶液不变蓝,反应后加入淀粉溶液变为蓝色,则反应过程中有I2生成,同时说明铜离子、碘酸根离子得电子发生还原反应,则Cu(IO3)2作氧化剂,碘化钾中碘离子失电子作还原剂;
(2)该反应中Cu(IO3)2得电子生成CuI、I2,所以还原产物是CuI、I2;
(3)Cu(IO3)2在反应中作氧化剂,根据氧化剂中所含有元素化合价降低的数值等于其反应中得到电子数目,可知1 mol Cu(IO3)2得到电子数目为[(2-1)+(5-0)×2]×1 mol=11 mol;
(4)该反应中NaBiO3是反应物,根据Bi元素守恒,Bi2(SO4)3是生成物,Bi元素由反应物到生成物,化合价降低,所以NaBiO3是氧化剂;NaMnO4中锰元素的化合价是+7价,MnSO4中锰元素的化合价是+2价,要选取还原剂,只能是化合价由低变高,所以MnSO4作还原剂,NaMnO4是氧化产物;再根据元素守恒,反应物中还有硫酸,产物中还有Na2SO4、H2O。因此该反应中,NaBiO3是氧化剂,MnSO4作还原剂;MnSO4→NaMnO4,锰元素由+2价→+7价,一个MnSO4失去5个电子;NaBiO3→Bi2(SO4)3,Bi元素由+5价→+3价,生成一个Bi2(SO4)3,得到4个电子,反应中得失电子的最小公倍数为20,则其化学反应方程式为![]() ;用单线桥法表示电子转移为:
;用单线桥法表示电子转移为: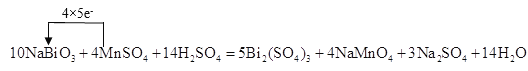 。
。


科目:高中化学 来源: 题型:
【题目】为更有效处理工业废气中排放的氮氧化物(NOx)、SO2等,减少大气污染。科学家不断对相关反应进行研究尝试。

(1)脱硝反应机理如图,Cu+的作用是___,C2H4参与的反应方程式__。
(2)选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,其反应原理主要为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g);ΔH=-1627kJmol-1
4N2(g)+6H2O(g);ΔH=-1627kJmol-1
①该方法应控制反应温度在315~400℃之间,反应温度不宜过高的原因是__。
②氨氮比n(NH3)/n(NO)![]() 会直接影响该方法的脱硝率。如图为350℃时,只改变氨气的投放量,NO的百分含量与氨氮比的关系图。当
会直接影响该方法的脱硝率。如图为350℃时,只改变氨气的投放量,NO的百分含量与氨氮比的关系图。当![]() >1.0时,烟气中NO含量反而增大,主要原因是___。
>1.0时,烟气中NO含量反而增大,主要原因是___。

(3)烟气脱硫、脱硝一体化技术是大气污染防治研究的热点。ClO2及NaClO2均是性能优良的脱硫脱硝试剂。
某研究小组用ClO2进行单独脱除SO2实验时,测得SO2的脱除率随溶液pH变化如图所示。当3<pH<7时,随pH的增大,SO2脱除率逐渐降低,其原因是___;在pH约7.8之后,随pH的增大,SO2脱除率又开始升高,其原因是___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①已知白磷和氯酸溶液可发生如下反应,将该反应进行配平:
______P4+_______HClO3+_______ ______=______HCl+____H3PO4
②白磷有毒,有实验室可采用CuSO4溶液进行处理,其反应为:11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
在该反应中30 mol CuSO4可氧化P4的物质的量是______mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒在指定溶液中能大量共存的是( )
A.pH=1的溶液中:CH3CH2OH、Cr2O![]() 、K+、SO
、K+、SO![]()
B.c(Ca2+)=0.1molL-1的溶液中:NH![]() 、C2O
、C2O![]() 、Cl-、Br-
、Cl-、Br-
C.加入铝粉放出大量H2的溶液:Fe2+、Na+、Cl-、NO![]()
D.含大量HCO![]() 的溶液中:C6H5O-、CO
的溶液中:C6H5O-、CO![]() 、Br-、K+
、Br-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1,下列说法正确的是( )
A.CO的燃烧热为-283 kJ·mol-1
B.CO的燃烧热为566 kJ·mol-1
C.CO的燃烧热ΔH=-283 kJ·mol-1
D.如图可表示由CO生成CO2的反应过程和能量关系
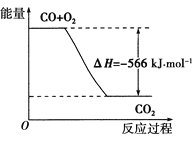
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨广泛用于生产化肥、制冷剂等方面。回答下列问题:
(1)实验室可用下图所示装置合成氨。

①合成氨时,还原铁粉的作用是________________。
②锥形瓶中盛有一定量的水,并滴有几滴酚酞试剂,反应—段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、____________和_________________。
⑵最近斯坦福大学研究人员发明了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。

①图中反应Ⅱ的化学方程式为____________________。
②反应Ⅲ中能量转化的方式是__________________(填“电能转变为化学能”或“化学能转变为电能”)。
(3)液氨可用作制冷剂,液氨气化时__________(填“释放”或“吸收”)能量;液氨泄漏遇明火会发生爆炸。已知部分化学键的键能数据如下表所示:
共价键 | N-H | O=O | N≡N | O-H |
键能/kJ·mol-1 | 391 | 498 | 946 | 463 |
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的反应热△H=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示。(电极材料为石墨)
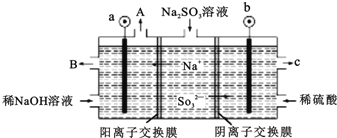
(1)写出用过量的NaOH溶液吸收烟气中的SO2的方程式___。
(2)图中a极要连接电源的(填“正”或“负”)___极,C口流出的物质是___。
(3)SO32放电的电极反应式为___。
(4)电解过程中阴极区碱性明显增强,用平衡移动原理解释原因___。
(二)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g)SO3(g)+NO(g),将体积比为1:2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1molSO2的同时生成1molNO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A 是农药生产中的一种中间体,其结构简式如图:

下列有关叙述中正确的是
A.l mo1 A和足量的H2发生加成反应,最多可以消耗4 mol H2
B.有机物A可以和Br2的CCl4溶液发生加成反应
C.有机物A和浓硫酸混合加热,可以发生消去反应
D.l mo1 A和足量的NaOH溶液反应,最多可以消耗3 mol NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com