
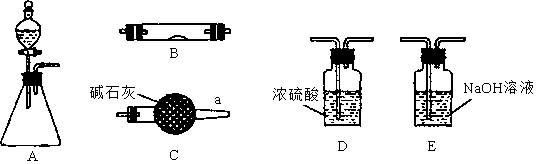


科目:高中化学 来源:不详 题型:实验题
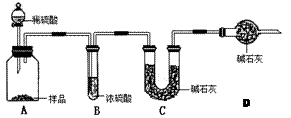
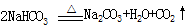 。请回答:
。请回答:| 分析与计算 分组 | 计算样品中碳酸钠的质量分数 | 实验结果的评价 | 实验失败的主要原因及对结果的影响 |
| 甲 | | 失 败 | |
| 乙 | |  成 功 成 功 | |
| 丙 | |  成 功 成 功 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 、
、 、Fe2+和结晶水,设计了下列操作步骤:①取少量该化合物加热,发现试管口处有液体,该液体能使无水硫酸铜变蓝;②另取少量该化合物溶于水中,滴加少量的氯水,再加入KSCN溶液,有血红色出现;③取少量溶液于试管中,加入盐酸,没有现象,再加入BaCl2溶液,有白色沉淀生成;④取少量溶液于试管中,加入浓的NaOH溶液,微热有使湿润的红色石蕊试纸变蓝的气体产生,同时也有白色沉淀产生,该沉淀很快变成灰绿色沉淀。
、Fe2+和结晶水,设计了下列操作步骤:①取少量该化合物加热,发现试管口处有液体,该液体能使无水硫酸铜变蓝;②另取少量该化合物溶于水中,滴加少量的氯水,再加入KSCN溶液,有血红色出现;③取少量溶液于试管中,加入盐酸,没有现象,再加入BaCl2溶液,有白色沉淀生成;④取少量溶液于试管中,加入浓的NaOH溶液,微热有使湿润的红色石蕊试纸变蓝的气体产生,同时也有白色沉淀产生,该沉淀很快变成灰绿色沉淀。| A.②中的现象说明一定有Fe2+ |
B.为了检验 ,可以将③中的试剂换为HNO3酸化的Ba(NO3)2 ,可以将③中的试剂换为HNO3酸化的Ba(NO3)2 |
| C.通过上述实验可确定该化合物的化学式为(NH4)2Fe(SO4)2·6H2O |
| D.④中的沉淀长时间放置会变成红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②③④ | C.②③ | D.①④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
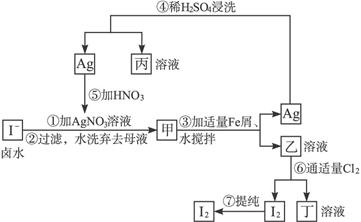
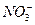 b.除去未反应的I-
b.除去未反应的I-查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
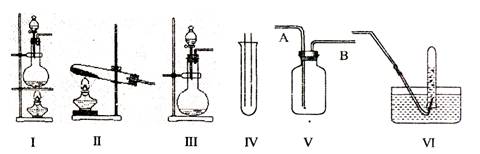
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com