
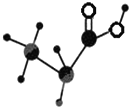
 如图是某种有机物的简易球棍模型,该有机物中只含有C、H、O三种元素,下列关于该有机物的说法中正确的是( )
如图是某种有机物的简易球棍模型,该有机物中只含有C、H、O三种元素,下列关于该有机物的说法中正确的是( )| A. | 结构简式是C3H6O2 | B. | 不能和NaOH溶液反应 | ||
| C. | 官能团是羟基 | D. | 能发生取代反应 |
科目:高中化学 来源: 题型:选择题
| A. | 25℃时18 g水 | |
| B. | 标准状况下含6.02×1023个原子的Cl2 | |
| C. | 标准状况下1 mol氨气 | |
| D. | 常温常压下44 g二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
 ;其最外层共有6种不同运动状态的电子;
;其最外层共有6种不同运动状态的电子;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R一定是第VIIA族元素 | B. | R的最高价氧化物为RO3 | ||
| C. | R可能是第二周期元素 | D. | R的气态氢化物易溶于水显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO+2H2═CH3OH | B. | CaCO3+2HCl═CaCl2+CO2↑+H2O | ||
| C. | 2H2+O2═2H2O | D. | CaO+H2O═Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O反应中,氧化剂与还原剂的物质的量之比是为8:3 | |
| B. | 硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水.该反应中氧化产物和还原产物的物质的量之比3:1 | |
| C. | 根据下列物质中S的化合价判断,H2S既有氧化性又有还原性 | |
| D. | 已知,物质的氧化能力Cl2>FeCl3>I2,故能发生反应2FeCl3+2KI═2FeCl2+2KCl+I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com