


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
 (2010?揭阳模拟)草酸(H2C2O4)是一种有机二元酸,水溶液中草酸的存在形态有三种,各形态的浓度分数α(H2C2O4-α0,HC2O4--α1,C2O42--α2)随溶液pH变化的关系如图所示.
(2010?揭阳模拟)草酸(H2C2O4)是一种有机二元酸,水溶液中草酸的存在形态有三种,各形态的浓度分数α(H2C2O4-α0,HC2O4--α1,C2O42--α2)随溶液pH变化的关系如图所示.| c(Na+) | ||
c(
|
| c(Na+) | ||
c(
|
| ||
| ||
| 酸 | 铁锈[Fe(OH)3]溶解量/g | 水垢(CaCO3)溶解量/g |
| 盐酸 | 0.7911 | 全溶 |
| 磷酸 | 0.1586 | 微溶 |
| 草酸 | 0.7399 | 0.0036 |
| 醋酸 | 0.1788 | 0.1655 |
查看答案和解析>>
科目:高中化学 来源: 题型:
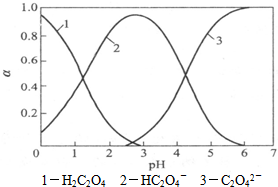 草酸(H2C2O4)是一种二元弱酸,受热能分解,它在水溶液中存在形式的分布与pH关系如图所示:
草酸(H2C2O4)是一种二元弱酸,受热能分解,它在水溶液中存在形式的分布与pH关系如图所示:
| ||
| ||
| 酸 | 铁锈[Fe(OH)3]溶解量/g | 水垢(CaCO3)溶解量/g |
| 盐酸 | 0.7911 | 全溶 |
| 磷酸 | 0.1586 | 微溶 |
| 草酸 | 0.7399 | 0.0036 |
| 醋酸 | 0.1788 | 0.1655 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 温度 序号 |
起始温度t1/℃ | 终止温度 T2/℃ |
温度差 △t/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 25 | 25 | 27.3 | ||
| 2 | 25 | 25 | 27.4 | ||
| 3 | 25 | 25 | 28.6 | ||
查看答案和解析>>
科目:高中化学 来源:安徽省马鞍山二中2011-2012学年高二下学期期中素质测试化学理科试题 题型:058
某研究性学习小组为探究在相同条件下,同浓度同体积的一元强酸和弱酸分别与同种金属反应时生成氢气的速率是否相同,组装了两套如下图所示的简易实验装置.该装置同时还可测定该温度和压强下的气体摩尔体积.

该实验的主要操作步骤如下∶
①配制浓度均为1 mol·L-1的盐酸和醋酸溶液;
②在广口瓶乙中装水,按图示连接好装置,检查装置的气密性;
③量取10.0 mL 1 mol·L-1的盐酸和醋酸溶液分别加入两套装置的锥形瓶中;
④称取两份质量均为a g的镁带(除去表面氧化膜、表面积相同),并固定于塑料杆末端;
⑤同时将塑料杆向下移动,使镁带浸入酸中至反应完全,记录反应的起止时间.
⑥反应结束后待温度恢复到室温,读出量筒中水的体积为V mL.
请根据上述步骤回答下列问题∶
(1)步骤④中,理论上称取的镁带质量不能少于________g.
(2)若水蒸气的挥发影响忽略不计,在该温度和压强下,气体摩尔体积为________L·mol-1.
(3)实验过程中观察到的主要现象是∶盛________(填“盐酸”或“醋酸”)的锥形瓶中反应更剧烈,反应完全用时较少;与足量镁带反应完全最终排出水的体积________(填序号字母).
A.盐酸更多
B.醋酸更多
C.一样多
(4)如果将上述实验改为∶在体积均为1 L,pH都等于2的盐酸和醋酸溶液中,分别投入0.65 g锌粒,则下图所示比较符合客观事实的是________(填序号字母).

查看答案和解析>>
科目:高中化学 来源:2010年广东省揭阳市高考化学模拟试卷(解析版) 题型:填空题
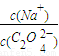 2(填“>”“═”或“<”);往该溶液中滴入氯化钙溶液后,
2(填“>”“═”或“<”);往该溶液中滴入氯化钙溶液后,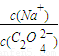 增加,可能的原因是 .
增加,可能的原因是 .| 酸 | 铁锈[Fe(OH)3]溶解量/g | 水垢(CaCO3)溶解量/g |
| 盐酸 | 0.7911 | 全溶 |
| 磷酸 | 0.1586 | 微溶 |
| 草酸 | 0.7399 | 0.0036 |
| 醋酸 | 0.1788 | 0.1655 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com