
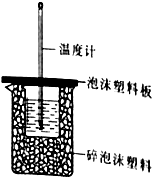
 (1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.
(1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.| 试管A | 试管B | |
| 加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、1mL0.05mol/L 酸性KMnO4,少量X |
| 实验现象 (间) | A大于B(填大于或小于) | |
| 结论 | 猜想Ⅱ正确 | |
分析 (1)①根据量热计的构造来判断该装置的缺少仪器;
②不盖硬纸板,会有一部分热量散失;
③为了保证酸或碱中的一方完全反应,往往保证另一方过量;
(2)①根据中和反应放热,温度升高,化学反应速率加快;
②依据高锰酸钾有强氧化性,能把草酸氧化成二氧化碳,同时自身被还原成锰离子来分析;
③猜想II是认为生成的Mn2+在反应中起到催化剂的作用,故应补充MnSO4,通过测量溶液褪色的时间来验证猜想;
④要通过对比实验来验证猜想Ⅱ,则实验B和实验A的加入试剂除了MnSO4固体不同,其他均应相同,据此分析.
解答 解:(1)①由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,
故答案为:环形玻璃搅拌棒;
②大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,
故答案为:偏小;
③为了确保盐酸被完全中和,所用氢氧化钠溶液稍过量;
故答案为:保证盐酸能够完全被中和;
(2)①猜想Ⅰ:此反应过程放热,温度升高,促使反应速率加快;
故答案为:放热;
②草酸和酸性高锰酸钾溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;
③考虑到Mn2+起了催化作用,所以实验还需要MnSO4及秒表;
故选B;
④要通过对比实验来验证猜想Ⅱ,则实验B和实验A的试剂的选择应除了MnSO4固体不同,其他均应相同,故试管B内加入的试剂是在试管A试剂的基础上多加了MnSO4,由于结论是猜想II成立,则试管B的褪色时间应该比试管A的更快;
故答案为:大于.
点评 本题考查了中和热的测定,影响反应速率的因素,明确要验证一个因素的改变对反应速率的影响,则必须保持其他影响因素一致,难度中等.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:解答题
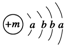 ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 55 mol•g-1 | B. | 55 mol | C. | 55 g•mol-1 | D. | 55g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别加入1mol/L的盐酸溶液,看有无气泡产生 | |
| B. | 分别取样配成溶液,滴加Ca(OH)2溶液,观察有无白色沉淀 | |
| C. | 用铂丝粘取固体在酒精灯火焰上灼烧,观察火焰的颜色,NaHCO3的焰色为紫色 | |
| D. | 分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第3列元素种类最多 | |
| B. | 每一列都有非金属元素 | |
| C. | 从上到下第1列元素的单质熔点逐渐升高,而第17列元素的单质熔点逐渐降低 | |
| D. | 只有第2列元素的原子最外层有2个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com