
分析 水的电离是吸热反应,升高温度促进水电离,则溶液的离子积常数增大,通过比较t℃)时和25℃时Kww的值判断,碳酸钠是强碱弱酸盐,水解促进水的电离,溶液中氢氧根离子是全部水电离出的,氢离子是碳酸根水解结合为弱离子后剩余在溶液中的离子.
解答 解:水的电离是吸热反应,升高温度促进水电离,氢离子和氢氧根离子浓度增大,则水的离子积常数增大,25℃时纯水中c(H+)=c(OH-)=10-7 mol/L,Kw=c(H+)•c(OH-)=10-14 ,某温度(T℃)时,水的离子积常数Kw=1×10-13>10-14,则该温度大于25℃,25℃.0.1mol•L-1的Na2CO3溶液在该温度下的PH为11,则水电离出的氢氧根离子浓度c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$=10-2mol/L,
故答案为:大于; 10-2.
点评 本题考查了水的电离平衡、水的离子积常数的影响因素以及计算等知识,注意知识的归纳和梳理是关键,难度不大.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
 ).其中既能使KMnO 4酸性溶液褪色又能与溴水反应使溴水褪色的是( )
).其中既能使KMnO 4酸性溶液褪色又能与溴水反应使溴水褪色的是( )| A. | ②④⑤⑧ | B. | ②⑤⑧ | C. | ②④⑤⑦ | D. | ②④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸碱中和滴定法测待测液浓度时,装标准液的滴定管用水洗后未用标准液润洗 | |
| B. | 用酸碱中和滴定法测待测液浓度时,装待测液的锥形瓶用水洗后用待测液润洗2~3次 | |
| C. | 测定中和反应的反应热时,将碱溶液缓慢倒入酸溶液中 | |
| D. | 用蒸馏水湿润的pH试纸测定硫酸钠溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
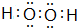
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
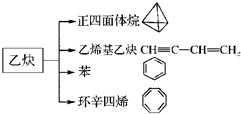 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题: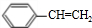 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$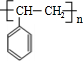
 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热反应的发生都需要加热,放热反应在常温下一定容易发生 | |
| B. | 若某反应正向进行时为放热反应,则该反应逆向进行时必为吸热反应 | |
| C. | 由“C(石墨)=C(金刚石)是吸热反应”可知石墨比金刚石稳定 | |
| D. | 不管是吸热反应还是放热反应,升高温度,反应速率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com