
25 ℃时,合成氨反应的热化学方程式为:
N2(g)+3H2(g) 2NH3(g)
△H=-92.4 kJ/mol
2NH3(g)
△H=-92.4 kJ/mol
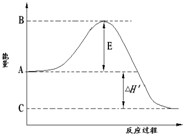
在该温度时,取2mol N2和7 mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是[ ]
A.92.4 kJ B.92.4 kJ ~184.8 kJ
C.小于184.8 kJ D.184.8 kJ
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
 合成氨工业是极为重要的化学工业,当今对合成氨工业的研究仍然充满活力.其合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ/mol.回答下列问题:
合成氨工业是极为重要的化学工业,当今对合成氨工业的研究仍然充满活力.其合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ/mol.回答下列问题:| 1 |
| 3 |
| 10 | 20 | 30 | 60 | |
| 300 | 52.0 | 64.2 | 71.0 | 84.2 |
| 400 | 25.1 | 38.2 | 47.0 | 65.2 |
| 500 | 10.6 | 19.1 | 26.4 | 42.0 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省等五校高三第二次联考理综化学试卷(解析版) 题型:填空题
(1)已知:O2 (g)= O2+ (g)+e- △H1= +1175.7 kJ·mol-1
PtF6(g)+ e-= PtF6-(g)???? △H2= - 771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- (g)?? △H3=+482.2 kJ·mol-1
则反应:O2(g)+ PtF6 (g) = O2+PtF6(s)的△H=_____ kJ·mol-1。
如图为合成氨反应在使用相同的催化剂,不同温度和压强条件下进行反 应,初始时N2和H2的体积比为1:3时的平衡混合物中氨的体积分数:

① 在一定的温度下,向体积不变的密闭容器中充入氮气和氢气发生上述反应,下列能说明反应达到平衡状态的是??????? 。
a.体系的压强保持不变?? ???? b.混合气体的密度保持不变
c.N2和H2的体积比为1:3????? d.混合气体的平均摩尔质量不变
②分别用vA(NH3)和vB(NH3)表示从反应开始到平衡状态A、B时的反应速率,则vA(NH3)??? vB(NH3)(填“>”、“<”或“=”),该反应的的平衡常数kA ??? kB(填“>”、“<”或“=”),在250 ℃、1.0×104kPa下达到平衡,H2的转化率为????? %(计算结果保留小数点后一位);
(3)25℃时,将a mol NH4NO3溶于水,溶液呈酸性,原因???????????????????????? ?????????? (用离子方程式表示)。向该溶液中加入bL氨水后溶液呈中性,则所加氨水的浓度为?????????? mol/L(用含a、b的代数式表示,NH3·H2O的电离平衡常数为Kb=2×10-5)
(4)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。电镀一段时间后,装置Ⅰ中溶液的pH ???? (填“变大”、“变小”或“不变”),a极电极反应方程式为????????????????? ;若电镀结束后,发现装置Ⅱ中阴极质量变化了25.6g(溶液中硫酸铜有剩余),则装置Ⅰ中理论上消耗甲烷????? L(标准状况下)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com